-
Composición centesimal 0001
El sulfato de amonio, 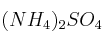 , se utiliza como fertilizante en agricultura. Calcula: a) el tanto por ciento en peso de nitrógeno en el compuesto; b) la cantidad de sulfato de amonio necesaria para aportar a la tierra 10 kg de nitrógeno.
, se utiliza como fertilizante en agricultura. Calcula: a) el tanto por ciento en peso de nitrógeno en el compuesto; b) la cantidad de sulfato de amonio necesaria para aportar a la tierra 10 kg de nitrógeno.
Masas atómicas: H = 1 ; N = 14 ; S = 32 ; O = 16
-
Masa atómica, masa molecular y mol 0001
Define los siguientes conceptos:
a) Masa atómica de un elemento.
b) Masa molecular.
c) Mol.
-
Reacciones químicas y reactivos en disolución 0002
Se prepara ácido clorhídrico por calentamiento de una mezcla de cloruro de sodio con ácido sulfúrico concentrado, según la reacción (sin ajustar):
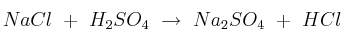
Calcula:
a) La masa, en gramos, de ácido sulfúrico del 90 de riqueza en peso que será necesario para producir 1 t de disolución concentrada de ácido clorhídrico del 42
de riqueza en peso que será necesario para producir 1 t de disolución concentrada de ácido clorhídrico del 42 en peso.
en peso.
b) La masa de cloruro de sodio consumida en el proceso.
Masas atómicas: H = 1 ; O = 16 ; Na = 23 ; S = 32 ; Cl = 35,5
-
Masa atómica y mol 0001
Razona si son verdaderas o falsas las afirmaciones siguientes:
a) La masa de un ión monovalente positivo es menor que la del átomo correspondiente.
b) El número atómico de un ion monovalente positivo es menor que el del átomo correspondiente.
c) En un gramo de cualquier elemento hay más átomos que habitantes tiene la Tierra, 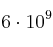 .
.
-
Reacciones químicas y reactivos en disolución 0001
La concentración de HCl de un jugo gástrico es 0,15 M.
a) ¿Cuántos gramos de HCl hay en 100 mL de ese jugo?
b) ¿Qué masa de hidróxido de aluminio, 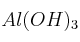 , será necesario para neutralizar el ácido anterior?
, será necesario para neutralizar el ácido anterior?
Masas atómicas: H = 1 ; O = 16 ; Al = 27 ; Cl = 35,5
 EBAU
EBAU