-
Calor específico de una aleación midiendo el calor que cede a una masa de agua
Se calentó una muestra de 25 g de una aleación hasta 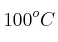 y se sumergió en un recipiente con 90 g de agua a
y se sumergió en un recipiente con 90 g de agua a 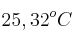 . La temperatura del agua aumentó hasta un valor final de
. La temperatura del agua aumentó hasta un valor final de 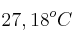 . Despreciando las pérdidas caloríficas hacia el ambiente y la capacidad calorífica del recipiente, ¿cuál es el calor específico de la aleación?
. Despreciando las pérdidas caloríficas hacia el ambiente y la capacidad calorífica del recipiente, ¿cuál es el calor específico de la aleación?
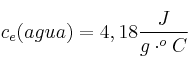
-
Masa de GLP necesaria para fundir plomo en crisol de hierro
En una empresa se funde plomo utilizando un crisol y un quemador de gas licuado de petróleo (GLP). El crisol es de hierro fundido, tiene una masa de 60 kg y una capacidad para fundir 300 kg de plomo.
Se requiere calcular la cantidad de calor necesario para fundir una carga de plomo y el volumen, expresado en litros, de GLP que se consume. Considera que la temperatura inicial del sistema crisol-plomo es de 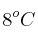
Datos: 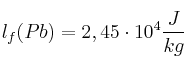 ;
; 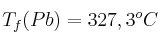 ;
; 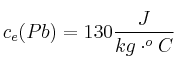 ;
; 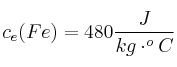 ;
; 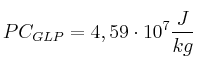 ;
; 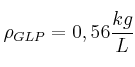
-
Temperatura final de una mezcla de hielo y agua al sumergir cobre caliente (5414)
En un recipiente aislado se tiene una mezcla de 50 g de hielo con 200 g de agua en equilibrio a 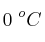 . Si se sumerge un trozo de 200 g de Cu a
. Si se sumerge un trozo de 200 g de Cu a 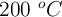 , calcula la temperatura final del sistema y el calor transferido por el cobre.
, calcula la temperatura final del sistema y el calor transferido por el cobre.
Datos: 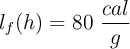 ;
; 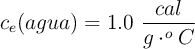 ;
; 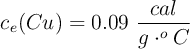 .
.
-
Calor total para calentar hielo hasta vapor de agua (5342)
¿Cuál es la energía requerida para llevar 20 libras de hielo, que está a 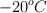 , a vapor de agua a
, a vapor de agua a 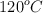 ?
?
Datos: 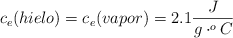 ;
; 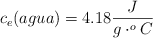 ;
; 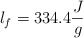 ;
; 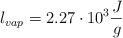
-
Calor transferido en la disolución y capacidad calorífica del NaOH
En 40 mL de agua con una temperatura de 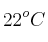 se diluyen 5 g de hidróxido de sodio, lo que incrementa la temperatura del agua en
se diluyen 5 g de hidróxido de sodio, lo que incrementa la temperatura del agua en 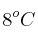 . Tomando como densidad del agua 1 g/mL y como calor específico del agua
. Tomando como densidad del agua 1 g/mL y como calor específico del agua 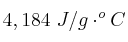 , determina:
, determina:
a) La temperatura final.
b) Tipo de proceso que se ha dado.
c) Calor de dilución.
d) La capacidad calorífica específica del NaOH, utilizando los datos indicados en el ejercicio.
e) La capacidad calorífica molar del NaOH, utilizando los datos indicados en el ejercicio.
 Calor
Calor