-
Constante de equilibrio y Principio de Le Chatelier 0001
En un recipiente cerrado se establece el siguiente equilibrio:
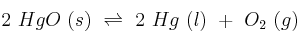 ;
; 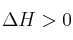
a) Escriba las expresiones de las constantes 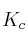 y
y 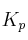 .
.
b) ¿Cómo afecta al equilibrio un aumento de la presión parcial de oxígeno?
c) ¿Qué le ocurrirá al equilibrio cuando se aumente la temperatura?
-
EBAU Andalucía: química (junio 2011) - ejercicio A.3 (1461)
Al calentar yodo en una atmósfera de dióxido de carbono, se produce monóxido de carbono y pentaóxido de diyodo:
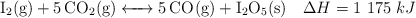
Justifica el efecto que tendrán los cambios que se proponen:
a) Disminución del volumen sobre el valor de la constante  .
.
b) Adición de 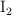 sobre la cantidad de CO.
sobre la cantidad de CO.
c) Reducción de la temperatura sobre la cantidad de  .
.
-
Equilibrio químico: principio de Le Chatelier (1415)
A partir de la reacción:
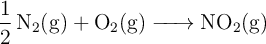
que transcurre a 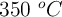 y una vez establecido el equilibrio:
y una vez establecido el equilibrio:
a) ¿Cómo influye una disminución del volumen del reactor en el equilibrio?
b) Si el proceso es endotérmico, ¿cómo afectará al equilibrio un descenso de la temperatura?
c) Si usamos un catalizador de 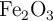 , ¿cómo afectará éste al equilibrio?
, ¿cómo afectará éste al equilibrio?
-
Equilibrio químico: Principio de Le Chatelier 0001
En condiciones estándar la descomposición del dióxido de nitrógeno es endotérmica. Responde razonadamente a las siguientes cuestiones:
a) ¿Variará la constante de equilibrio si se aumenta la concentración de oxígeno en el equilibrio?
b) ¿Será iguales los valores de  y
y  en esas condiciones?
en esas condiciones?
c) ¿Hacia dónde evoluciona el equilibrio si se produce un descenso en la presión del sistema?
-
EBAU Andalucía: química (junio 2010) - ejercicio A.3 (1036)
Se dispone de una disolución acuosa saturada de 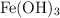 , compuesto poco soluble.
, compuesto poco soluble.
a) Escribe la expresión del producto de solubilidad para este compuesto.
b) Deduce la expresión que permite conocer la solubilidad del hidróxido a partir del producto de solubilidad.
c) Razona cómo varía la solubilidad del hidróxido al aumentar el pH de la disolución.
 Le Chatelier
Le Chatelier