-
Entalpía de reacción a partir de entalpías de formación (1986)
El etano reacciona con el ácido nítrico, a alta temperatura, para dar nitroetano y agua, siendo todo el proceso homogéneo y en fase gaseosa. Calcula:
a) La entalpía de reacción para el proceso.
b) El volumen de nitroetano que se obtendría cuando la energía intercambiada en el proceso es 400 kJ, si la temperatura es 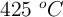 y la presión una atmósfera.
y la presión una atmósfera.
Datos: 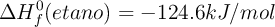 ;
; 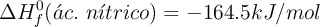 ;
;  ;
; 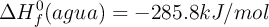
-
Reacciones químicas y reactivos en disolución 0002
Se prepara ácido clorhídrico por calentamiento de una mezcla de cloruro de sodio con ácido sulfúrico concentrado, según la reacción (sin ajustar):
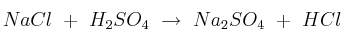
Calcula:
a) La masa, en gramos, de ácido sulfúrico del 90 de riqueza en peso que será necesario para producir 1 t de disolución concentrada de ácido clorhídrico del 42
de riqueza en peso que será necesario para producir 1 t de disolución concentrada de ácido clorhídrico del 42 en peso.
en peso.
b) La masa de cloruro de sodio consumida en el proceso.
Masas atómicas: H = 1 ; O = 16 ; Na = 23 ; S = 32 ; Cl = 35,5
-
Reacciones químicas y reactivos en disolución 0001
La concentración de HCl de un jugo gástrico es 0,15 M.
a) ¿Cuántos gramos de HCl hay en 100 mL de ese jugo?
b) ¿Qué masa de hidróxido de aluminio, 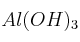 , será necesario para neutralizar el ácido anterior?
, será necesario para neutralizar el ácido anterior?
Masas atómicas: H = 1 ; O = 16 ; Al = 27 ; Cl = 35,5
-
Reacciones químicas con rendimiento 0002
Se hace reaccionar ácido clorhídrico con una muestra de 15 g de aluminio. ¿Cuál es el volumen de hidrógeno, medido en condiciones normales, que se obtiene si la reacción tiene un rendimiento del 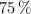 ?
?
-
Reacciones químicas con rendimiento 0001 (EvAU)
Se hacen reaccionar 10 g de cinc metálico con ácido sulfúrico en exceso. Calcula:
a) El volumen de hidrógeno que se obtiene medido a 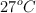 y 740 mm de Hg de presión.
y 740 mm de Hg de presión.
b) La masa de sulfato de cinc formada si la reacción tiene un rendimiento del 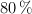 .
.
Datos: 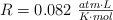 ; Zn = 65.4 ; S = 32 ; O = 16.
; Zn = 65.4 ; S = 32 ; O = 16.
 Reacciones químicas
Reacciones químicas