-
Estequiometría: Gases y disoluciones 0001
Se dispone de una disolución acuosa de HCl, cuya densidad es de 1,03 g/mL. Se toman 5 mL de esta disolución a los que se les va añadiendo cinc en polvo hasta que se observa que cesa el desprendimiento de gas, momento en el que se para la reacción y se mide que se han desprendido 70 mL de gas, medidos en c.n.
a) Indica la naturaleza del gas que se desprende.
b) Halla los gramos de cinc que han reaccionado en el HCl.
c) Halla la concentración en  en peso de la disolución de HCl.
en peso de la disolución de HCl.
d) ¿Cuál es la molaridad y la molalidad de la disolución de HCl?
-
Volumen de ácido sulfúrico a partir de pirita con una pureza dada (1597)
La producción de ácido sulfúrico a partir de la pirita se realiza mediante la siguiente serie de reacciones: a) tueste del 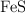 ; b) oxidación del
; b) oxidación del  ; c) hidratación del
; c) hidratación del 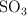 . ¿Qué volumen de
. ¿Qué volumen de 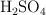 concentrado, del
concentrado, del 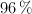 de riqueza y densidad 1.84 g/mL, puede obtenerse teóricamente a partir de 100 kg de pirita del
de riqueza y densidad 1.84 g/mL, puede obtenerse teóricamente a partir de 100 kg de pirita del 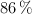 de pureza? Escribe y ajusta en cada apartado la reacción correspondiente.
de pureza? Escribe y ajusta en cada apartado la reacción correspondiente.
-
Reacciones químicas: estequiometría, gases y reactivo limitante 0001
En un recipiente de vidrio de 20 L existe hidrógeno en c.n. Se introduce en él el nitrógeno que contiene un balón de 4 L a 5 atm y 27 ºC. La mezcla resultante queda a 10 ºC.
a) ¿Cuál será la presión de la mezcla resultante?
b) Si se hace reaccionar uno con otro para formar amoniaco, hasta que uno de ellos se acabe, ¿qué sobra y en qué cantidad?
c) ¿Cuál será la presión final, después de la reacción, si la temperatura se llevó a 27 ºC?
-
Reacciones químicas: rendimiento de reacción y reactivos sin reaccionar (1595)
Se calientan 10 g de Mg con un litro de nitrógeno, medido a 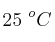 y 720 mm Hg de presión.
y 720 mm Hg de presión.
a) ¿Qué cantidad de nitruro de magnesio se formará si la reacción presenta un rendimiento del 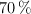 .
.
b) ¿Cuáles serán las cantidades de los reactivos que quedarán sin reaccionar?
-
Reacciones químicas: rendimientos 0001
Determina el rendimiento de la reacción de combustión del carbono para dar dióxido de carbono si con 10 g del primero se obtienen 14,9 L, medidos en c.n, del segundo.
 Reacciones químicas
Reacciones químicas