-
Configuración electrónica, estados de oxidación y tipos de enlace (850)
Sabiendo que los números atómicos de A, B y C son 16, 17 y 20 respectivamente:
a) Escribe sus configuraciones electrónicas.
b) Deduce sus estados de oxidación más probables.
c) Razona el tipo de enlace que se establecerá entre la pareja B/C y entre la pareja A/B.
-
Cuestión sustancias puras 0006
Un compuesto está formado por tres átomos, de sólo dos elementos, y su masa molecular es 150,7. Sabiendo que uno de los átomos es el estaño, Sn:
a) Escribe su fórmula molecular.
b) ¿Cuántas moléculas contienen 2 g de compuesto?
-
Fórmulas moleculares de varias sustancias
Escribe las moléculas que cumplen con las siguientes características:
a) Cuatro átomos en total y el triple de átomos de hidrógeno que de nitrógeno.
b) Dos átomos de potasio y un átomo de azufre.
c) El mismo número de átomos de hidrógeno que de oxígeno. Cuatro átomos en total.
d) Dos átomos de hidrógeno, un átomo de azufre y el cuádruple de átomos de oxígeno.
-
Verdadero o falso sobre el bloque de materia (499)
Razona si son verdaderas o falsas las siguientes afirmaciones:
a) Las sustancias puras son aquellas que están formadas por un tipo de átomo de los que están en la tabla periódica.
b) Ernest Rutherford estuvo trabajando con el tubo de rayos catódicos y dedujo la masa y la carga del electrón.
c) La masa atómica decimal de ciertos elementos se debe a que, al sumar la masa de los electrones, se obtienen valores decimales.
d) La molécula 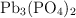 contiene un total de trece átomos.
contiene un total de trece átomos.
-
Cuestión moléculas 0003
Escribe la molécula que se indica en cada caso:
a) Formada por hidrógeno y nitrógeno en proporción 3:1.
b) Tres átomos en total y la mitad de átomos de oxígeno que de hidrógeno.
c) Siete átomos en total. El doble de átomos de hidrógeno que de azufre y el doble de átomos de oxígeno que de hidrógeno.
 Moléculas y átomos
Moléculas y átomos