-
Ley general de los gases (3675)
Un gas ideal está a una temperatura T y ocupa un volumen V a presión P. Si varía su presión a 4 P y su temperatura a 2 T. ¿Cuál es el nuevo volumen?
-
Ley de Boyle y cambios de unidades 0001
Un litro de dióxido de carbono gaseoso, a 27 ºC y presión atmosférica, se lleva hasta una presión de 10 mm de Hg. ¿Cuál será ahora el volumen que ocupe el gas si la temperatura no ha variado?
-
Moles de un gas conocidos presión, temperatura y volumen 0001
Calcula el número de moles de un gas que ocupa un volumen de 0,3 litros a 2,3 atmósferas de presión y a 273 K de temperatura.
-
Leyes de los gases y representación gráfica (3473)
En un recipiente cerrado de volumen constante se ha introducido un gas y se han medido los siguientes valores:
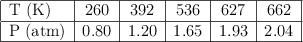
a) ¿De qué ley de los gases se trata?
b) ¿Cuánto será la presión del gas cuando la temperatura sea de 430 K?
c) ¿Qué valor de temperatura corresponde a una presión de 5 atm?
d) Dibuja la gráfica que representa los valores de la gráfica.
-
Ley de Raoult 0001
El aire seco está compuesto de un 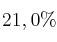 de oxígeno. Calcula la presión parcial de oxígeno en una muestra de aire a 738 mm Hg.
de oxígeno. Calcula la presión parcial de oxígeno en una muestra de aire a 738 mm Hg.
 Gases
Gases