-
Aplicación de estequiometría y reactivo limitante (2638)
Halla para la reacción:

a) El número de moles presentes de cada sustancia.
b) Si se duplica el número de moles de 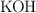 , ¿cuántos moles de
, ¿cuántos moles de 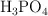 se requieren para reaccionar? ¿Cuántos moles de
se requieren para reaccionar? ¿Cuántos moles de 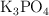 se producen?
se producen?
c) Si se combinan 3 moles de 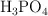 con 10 mol de
con 10 mol de 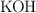 , terminada la reacción, ¿cuántos moles de sal y de agua se producen? ¿Cuántos moles de cada sustancia se encuentran?
, terminada la reacción, ¿cuántos moles de sal y de agua se producen? ¿Cuántos moles de cada sustancia se encuentran?
-
Aplicación de la estequiometría de una reacción 0001
En la reacción:
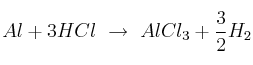
¿Cuántos moles se producen si reaccionan 5 mol de Al y 8 mol de HCl?
-
Reactivo limitante en una reacción química 0001
Se hacen reaccionar 7,5 moles de cloro con 5,5 de aluminio para formar cloruro de aluminio. Indica la cantidad de cloruro de aluminio que se espera obtener.
-
Reacción química: reactivos en disolución 0001
Se hacen reaccionar 25 mL de HCl al 12 con 30 mL de NaOH al 10
con 30 mL de NaOH al 10 , ambos en masa. ¿Qué cantidad de NaCl se obtendrá?
, ambos en masa. ¿Qué cantidad de NaCl se obtendrá?
Datos: 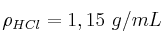 ;
; 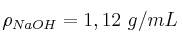
-
Reactivo limitante y ley de Lavoissier 0001
En una reacción química debe cumplirse la ley de conservación de la masa, donde la cantidad de reactivos debe ser igual a la del producto. En la reacción:
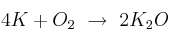
la masa de 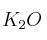 que se forme a partir de 78 g de K y 72 g de
que se forme a partir de 78 g de K y 72 g de 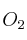 será:
será:
a) 94 g
b) 188 g
c) 47 g
d) 141 g
Masas atómicas: K = 39 ; O = 16.
 Reactivo limitante
Reactivo limitante