-
Porcentaje en masa, molaridad y molalidad de una disolución de urea
Se prepara una disolución disolviendo 55 g de urea (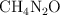 ) en 950 g de agua. Se sabe que la densidad de esta disolución es de
) en 950 g de agua. Se sabe que la densidad de esta disolución es de 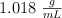 . Expresa la concentración de la disolución de urea en:
. Expresa la concentración de la disolución de urea en:
a) Porcentaje en masa.
b) Molaridad.
c) Molalidad.
-
Preparación de disoluciones en porcentaje en masa y molaridad (6217)
a) ¿Cómo prepararías 120 mL de una disolución de 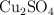 con una densidad de
con una densidad de 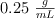 y porcentaje en masa del
y porcentaje en masa del 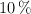 ?
?
b) Partiendo de dicha disolución, ¿cómo prepararías una dilución de 150 mL de concentración 0.05 M? Indica detalladamente el proceso.
(Masas atómicas: Cu = 63.5 ; O = 16 ; S = 32).
-
Molaridad final de una mezcla de dos disoluciones de molaridades distintas de fenol (6210)
Se prepara una disolución con 40 mL de una solución de fenol 0.1 M que se mezclan con 60 mL de fenol 1 M, que ha estado diluido previamente a la mitad. ¿Cuál es la molaridad de la solución final?
-
Volúmenes de dos disoluciones para obtener una tercera de una molaridad definida (6200)
Se desea preparar una solución de ácido sulfúrico 0.5 M de 300 mL y para ello se tienen dos soluciones del ácido; la primera de concentración 0.2 M y la segunda 1.5 M. Determina el volumen de ambas soluciones necesario para la mezcla.
-
Ampliación: titulación de una solución de trabajo para obtener concentración desconocida (6197)
En el laboratorio se encuentra una disolución de ácido nítrico cuya concentración es desconocida. Para valorarla, una alumna tomó una alícuota de 20.00 mL en pipeta volumétrica y la diluyó hasta 250 mL en un matraz aforado, rotulándolo como disolución de trabajo. Paso seguido tomó alícuotas de 10.00 mL en pipeta volumétrica por triplicado y las tituló con una disolución de hidróxido de potasio 0.1375 M empleando una bureta, obteniendo los siguientes resultados: muestra A = 9.05 mL, muestra B = 9.10 mL y muestra C = 9.15 mL. A partir de estos resultados, calcula las concentraciones de la disolución de trabajo y la de concentración desconocida.
 Molaridad
Molaridad