-
Presiones parciales y constante de equilibrio 0001
A 25 °C la descomposición del tetraóxido de dinitrógeno:
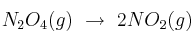
tiene una constante de equilibrio 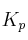 de 0,144. En el equilibrio, la presión total del sistema es 0,48 atmósferas. ¿Cuál es la presión parcial de cada gas en equilibrio?
de 0,144. En el equilibrio, la presión total del sistema es 0,48 atmósferas. ¿Cuál es la presión parcial de cada gas en equilibrio?
-
Espontaneidad, entropía y equilibrio (2102)
Responde, razonando cada caso, a las preguntas referidas a la reacción:

a) Si el valor de 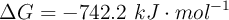 , ¿hacia dónde ocurre la reacción? ¿Es espontánea o no?
, ¿hacia dónde ocurre la reacción? ¿Es espontánea o no?
b) ¿Hacia dónde ocurre la reacción si se le agrega  ?
?
c) Para que la reacción llegue al equilibrio, ¿cuál sería el valor de 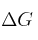 ?
?
d) Basándote en el valor de 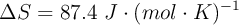 , ¿es una reacción espontánea o no?
, ¿es una reacción espontánea o no?
-
Interpretación de la constante de equilibrio 0001
Con base al valor de 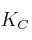 decide si se espera o no que la reacción sea casi completa en equilibrio para cada caso:
decide si se espera o no que la reacción sea casi completa en equilibrio para cada caso:
a) 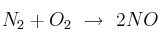 donde
donde 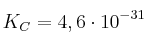
b) 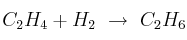 donde
donde 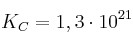
-
Grado de disociación y constante de equilibrio 0001
La reacción de equilibrio:
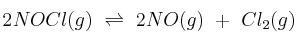
se ha estudiado a 462 ºC y a un volumen constante de 1,00 litro. Inicialmente se pusieron 2,0 mol de NOCl en el recipiente y, cuando se estableció el equilibrio, se observó que se había disociado el 33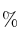 del NOCl. Calcula la constante de equilibrio.
del NOCl. Calcula la constante de equilibrio.
-
Constante de equilibrio y Principio de Le Chatelier 0001
La descomposición del carbonato cálcico es un proceso endotérmico, en condiciones estándar, en el que se obtienen óxido de calcio y dióxido de carbono. Responde razonadamente a las siguientes cuestiones:
– a) ¿Variará la constante de equilibrio si retiramos parte del óxido de calcio obtenido?
– b) ¿Coincidirán los valores de 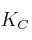 y
y 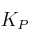 en esas condiciones?
en esas condiciones?
– c) ¿Cómo evoluciona el equilibrio si se disminuye la presión del sistema? ¿Y si se aumenta la temperatura?
 Constante equilibrio
Constante equilibrio