-
Repaso: caso práctico de materia y reacciones químicas (7296)
Cuando el cinc, cuyo número atómico es 30 y tiene 35 neutrones en su núcleo, reacciona con el cloruro de hidrógeno, siendo la masa atómica del hidrógeno 1 u y teniendo el cloro 17 protones y 18 neutrones, se forman cloruro de cinc e hidrógeno gaseoso. Responde a las siguientes cuestiones:
a) Escribe la ecuación química que tiene lugar.
b) Si reaccionan 36 g del compuesto covalente con exceso del metal, ¿qué masa del compuesto iónico se obtiene?
c) ¿Qué volumen de gas se obtendrá, medido en condiciones normales, si se hacen reaccionar 50 g de metal puro con exceso de clorano?
d) ¿Cuál sería la masa de gas que se obtendría en el apartado b) si el isótopo del cloro usado fuese el 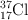 ? ¿Cuántos protones y neutrones presenta este isótopo?
? ¿Cuántos protones y neutrones presenta este isótopo?
e) ¿Cuántas moléculas y cuántos átomos de hidrógeno estarán contenidos en el volumen del apartado c)?
-
Volumen de disolución de ácido sulfúrico y masa de cinc para obtener un volumen de hidrógeno (7284)
Para obtener 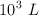 de hidrógeno, en condiciones normales, ¿qué volumen de ácido sulfúrico, de una riqueza del
de hidrógeno, en condiciones normales, ¿qué volumen de ácido sulfúrico, de una riqueza del 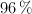 en peso y densidad de
en peso y densidad de 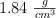 , y qué masa de cinc se necesitan?
, y qué masa de cinc se necesitan?
-
Volumen de aire para oxidar suficiente glucosa por hora en el organismo (7264)
La oxidación de la glucosa en el cuerpo se realiza de acuerdo con la reacción redox:

Si el consumo de glucosa de un organismo es de 2.77 mol/día, ¿cuál será el volumen de aire, a  y la presión de 1 bar, que debo respirar para lograr esta oxidación durante una hora?
y la presión de 1 bar, que debo respirar para lograr esta oxidación durante una hora?
-
Masa de hierro y volumen de ácido sulfúrico necesarios para obtener un volumen de hidrógeno (7243)
Se quieren obtener 10 L de 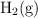 a
a 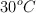 y 780 torr de presión y se dispone de hierro al
y 780 torr de presión y se dispone de hierro al 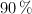 de pureza y de ácido sulfúrico 1 M. ¿Cuántos gramos de ese hierro y cuántos mililitros del ácido serán necesarios?
de pureza y de ácido sulfúrico 1 M. ¿Cuántos gramos de ese hierro y cuántos mililitros del ácido serán necesarios?
Masa atómica del hierro 56.
-
Volumen de nitrógeno y moléculas de oxígeno necesarias para una reacción (7000)
El nitrógeno reacciona con el oxígeno para formar el tetraóxido de dinitrógeno.
a) Escribe la ecuación química sabiendo que todas las sustancias son gaseosas.
b) Calcula el volumen de nitrógeno, medido en condiciones normales, que sería necesario para obtener 34 g de tetraóxido de dinitrógeno.
c) ¿Cuántas moléculas de oxígeno reaccionarán?
Datos: N = 14 ; O = 16 ; 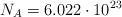 .
.
 Gases
Gases