-
Fórmula molecular de un compuesto que se quema y se vaporiza (6521)
Por combustión de 0.5 g de una sustancia formada por C, H y O se obtuvieron 0.69 g de  y 0.56 g de
y 0.56 g de 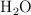 . Al vaporizar 1.6 g de esta sustancia se obtuvieron
. Al vaporizar 1.6 g de esta sustancia se obtuvieron 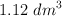 de vapor en condiciones normales de P y T. Halla la fórmula molecular de la sustancia.
de vapor en condiciones normales de P y T. Halla la fórmula molecular de la sustancia.
-
Presión final de una mezcla de gases (6150)
Tres frascos de 1 L, todos a 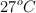 , han sido intercomunicados mediante espitas inicialmente cerradas. El primer frasco contiene 1 g de
, han sido intercomunicados mediante espitas inicialmente cerradas. El primer frasco contiene 1 g de 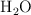 , el segundo contiene
, el segundo contiene 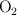 a la presión de 1 atm y el tercero 1 g de
a la presión de 1 atm y el tercero 1 g de 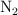 . A la temperatura de
. A la temperatura de 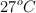 , la presión de vapor del agua es 0.038 atm. Calcula:
, la presión de vapor del agua es 0.038 atm. Calcula:
a) La presión inicial en cada frasco.
b) Si se abren las espitas y se espera a que se alcance el equilibrio, ¿cuál será la presión en el sistema?
c) Si la temperatura del sistema se eleva a 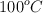 , ¿cuál será entonces la presión?
, ¿cuál será entonces la presión?
-
Aplicación de la ley general de los gases a varios sistemas (6028)
Completa la siguiente tabla para cada sustancia gaseosa:
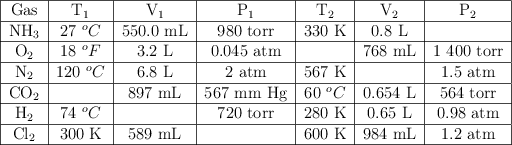
-
Ampliación: ecuación de estado de los gases al variar porcentualmente P y T
Un gas ocupa un volumen de 50 L. ¿Qué volumen ocupará si la presión aumenta en un 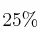 y la temperatura en un
y la temperatura en un  ?
?
-
Moles de un sistema gaseoso que sufre varias transformaciones y estado final (5765)
Un gas ideal se encuentra a una presión de 5.00 atm, a una temperatura de 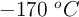 y ocupa un volumen de 50.0 L. El gas duplica su volumen mediante un proceso a temperatura constante, luego se enfría a volumen constante hasta alcanzar una presión de 1.50 atm. Determina:
y ocupa un volumen de 50.0 L. El gas duplica su volumen mediante un proceso a temperatura constante, luego se enfría a volumen constante hasta alcanzar una presión de 1.50 atm. Determina:
a) El número de moles de gas contenido en el sistema.
b) La presión al final de la expansión.
c) La temperatura final.
 Gases
Gases