-
Masa molar y fórmulas empírica y molecular de la aspirina (6895)
El ácido acetilsalicílico, conocido comercialmente como aspirina®, está formado por un 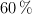 de carbono, un
de carbono, un 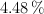 y el resto de oxígeno. Se evaporan 28.8 g de producto en un recipiente de 1.5 L, a
y el resto de oxígeno. Se evaporan 28.8 g de producto en un recipiente de 1.5 L, a 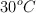 y 3 atm de presión. Calcula:
y 3 atm de presión. Calcula:
a) La fórmula empírica.
b) La masa molar.
c) La fórmula molecular.
-
Moles y moléculas en una masa de NaCl (6462)
Pesamos en un vidrio de reloj 100 g de NaCl. ¿Cuántos moles y moléculas están contenidos en esa masa?
Masas atómicas: Na = 23 ; Cl = 35.5
-
Moléculas contenidas en medio gramo de aspirina (6450)
La fórmula de la aspirina es 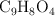 . ¿Cuántas moléculas hay en un comprimido de 0.5 g?
. ¿Cuántas moléculas hay en un comprimido de 0.5 g?
-
Masa molecular de varias sustancias a partir de sus pesos atómicos (6416)
Calcula la masa molecular de las siguientes sustancias: a) 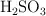 , b)
, b) 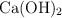 , c)
, c) 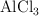 y d)
y d) 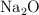 .
.
Masas atómicas: H = 1 ; Ca = 40 ; Na = 23 ; S = 32 ; Al = 27 ; O = 16 ; Cl = 35.
-
Refuerzo: masa de una sal para hacer una disolución 2 molar (6359)
¿Cuántos gramos de 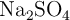 se necesitan para preparar 250 mL de solución de dicha sal con concentración
se necesitan para preparar 250 mL de solución de dicha sal con concentración 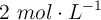 ?
?
 Masa molecular
Masa molecular