-
EBAU Madrid: química (junio 2022) pregunta A.5 (7635)
El clorato de potasio, en medio ácido, reacciona con aluminio formándose tricloruro de aluminio, cloro molecular, cloruro de potasio y agua.
a) Formula y ajusta las semirreacciones de oxidación y reducción que tienen lugar.
b) Ajusta las reacciones iónica y molecular por el método del ion-electrón.
c) Calcula el volumen de una disolución de clorato de potasio de concentración 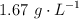 que se necesita para oxidar 0.54 g de hierro.
que se necesita para oxidar 0.54 g de hierro.
Masas atómicas (u): O = 16.0 ; Al = 27.0 ; Cl = 35.5 ; K = 39.1
-
EBAU Andalucía: química (junio 2021) pregunta C.4 (7268)
Una muestra de 3.25 g de nitrito de potasio impuro, disuelta en agua acidificada con ácido sulfúrico, se hace reaccionar con permanganato de potasio:
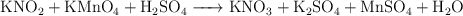
a) Ajusta las ecuaciones iónica y molecular por el método del ion-electrón.
b) Calcula la riqueza en 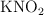 de la muestra inicial si se han consumido 50 mL de
de la muestra inicial si se han consumido 50 mL de 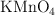 0.2 M.
0.2 M.
Masas atómicas relativas: K = 39 ; O = 16 ; N = 14.
-
Obtención gráfica de la cinética de la descomposición del agua oxigenada gráficamente (7257)
Se estudió a  la descomposición de agua oxigenada en solución acuosa en presencia de catalasa. Para este estudio se tomaron muestras a distintos intervalos y se valoró la concentración de agua oxigenada con permanganato de potasio en medio ácido. Se obtuvieron los siguientes resultados:
la descomposición de agua oxigenada en solución acuosa en presencia de catalasa. Para este estudio se tomaron muestras a distintos intervalos y se valoró la concentración de agua oxigenada con permanganato de potasio en medio ácido. Se obtuvieron los siguientes resultados:
![\begin{tabular}{|c|c|} \hline t\ (min) & [\ce{H2O2}]\cdot 10^3\ (\text{M})\\ \hline 0 & 46.0\\ \hline 5 & 37.1\\ \hline 10 & 30.0\\ \hline 20 & 19.6\\ \hline 30 & 12.3\\ \hline 50 & 5.00\\ \hline \end{tabular} \begin{tabular}{|c|c|} \hline t\ (min) & [\ce{H2O2}]\cdot 10^3\ (\text{M})\\ \hline 0 & 46.0\\ \hline 5 & 37.1\\ \hline 10 & 30.0\\ \hline 20 & 19.6\\ \hline 30 & 12.3\\ \hline 50 & 5.00\\ \hline \end{tabular}](local/cache-TeX/6fdb6a479f028e4aff7c1e65535e787d.png)
a) Determina gráficamente el orden de la reacción y calcula el valor de la constante de velocidad y el tiempo de vida media.
b) Escribe las ecuaciones de la valoración balanceadas. Si la valoración se hizo sobre una alícuota de 25 mL y con una solución de permanganato de potasio, preparada disolviendo 2.8 g de sal en 500 mL de solución, calcula cuántos mL de solución de permanganato de potasio se gastaron a los tiempos 0 y 20 minutos.
-
Reacción redox entre una aleación de cobre y ácido nítrico (6127)
Cuando se hacen reaccionar 200 g de una aleación, que contiene cobre en un 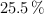 , con 180 mL de una disolución de ácido nítrico al
, con 180 mL de una disolución de ácido nítrico al 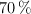 en masa y densidad 1.41 g/mL, se obtienen como productos de reacción óxido de nitrógeno(II), nitrato de cobre(II) y agua con un rendimiento del
en masa y densidad 1.41 g/mL, se obtienen como productos de reacción óxido de nitrógeno(II), nitrato de cobre(II) y agua con un rendimiento del 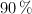 .
.
a) Ajusta la reacción que tiene lugar empleando el método del ion-electrón, indica cuál es el agente oxidante y el agente reductor, así como los estados de oxidación de las especies oxidadas y reducidas.
b) Calcula los gramos de nitrato de cobre(II) que se obtienen.
c) Si el óxido de nitrógeno(II) se recoge sobre agua a 293 K y 1 atm, calcula el volumen recogido.
Masas atómicas: Cu = 63.5 ; N = 14 ; O = 16 ; H = 1.
-
Volumen de disolución 0.1 normal de permanganato de sodio para valorar oxalato de sodio (6057)
¿Qué volumen de solución 0.1000 N de 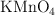 se necesitaría para valorar 0.1980 g de oxalato de sodio con una pureza del
se necesitaría para valorar 0.1980 g de oxalato de sodio con una pureza del 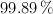 ?
?
 Estequiometría
Estequiometría