-
Reacciones químicas: reactivo limitante, impurezas y rendimiento de reacción (6294)
En el laboratorio se puede producir 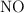 gaseoso haciendo reaccionar cobre metálico con ácido nítrico diluido, según la siguiente ecuación química:
gaseoso haciendo reaccionar cobre metálico con ácido nítrico diluido, según la siguiente ecuación química:
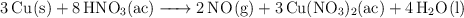
a) Indica cuál es el agente oxidante en esta reacción redox.
b) ¿Qué volumen de ese gas, a 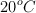 y 750 mm Hg, se puede preparar a partir de 35 g de cobre y 0.6 moles de ácido nítrico? Considera comportamiento de gas ideal para el óxido de nitrógeno.
y 750 mm Hg, se puede preparar a partir de 35 g de cobre y 0.6 moles de ácido nítrico? Considera comportamiento de gas ideal para el óxido de nitrógeno.
c) ¿Cuál sería ese volumen si el cobre a emplear contuviera un 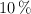 en peso de impurezas no reactivas y se supiera que el rendimiento máximo de la técnica es del
en peso de impurezas no reactivas y se supiera que el rendimiento máximo de la técnica es del 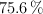 ?
?
Datos: Cu = 63.5 ; 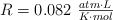
-
Ampliación: masa de bicarbonato de sodio para que un cohete se eleve el máximo
Hemos construido un cohete con un depósito de un litro y queremos hacerlo subir usando la reacción entre el vinagre y el bicarbonato de sodio. ¿Qué cantidad de la sal habrá que utilizar para que alcance la máxima altura, sabiendo que nuestro vinagre contiene un 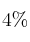 de ácido acético en volumen? Considera que la densidad del vinagre es 1 g/mL.
de ácido acético en volumen? Considera que la densidad del vinagre es 1 g/mL.
Masas atómicas: C = 12 ; H = 1 ; O = 16 ; Na = 23
-
Reactivo limitante y masa de producto a partir de reactivos impuros (5499)
La siguiente es una reacción espontánea del aluminio metálico con bromo, un no metal líquido. La ecuación es la siguiente:
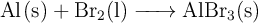
a) Si se hicieron reaccionar 12 g de aluminio (al 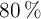 de pureza) y 56 g de bromo (al
de pureza) y 56 g de bromo (al 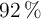 de pureza), ¿cuál es la sustancia que actúa como reactivo limitante?
de pureza), ¿cuál es la sustancia que actúa como reactivo limitante?
b) ¿Cuántos gramos de bromuro de aluminio se producen si el rendimiento de la reacción es del 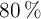 ?
?
Masas atómicas: Al = 27 y Br = 80.
-
Obtención de óxido de hierro(III) a partir de sulfuro de hierro(II) (4716)
Para la obtención de óxido de hierro(III), según la siguiente reacción:
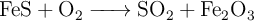
a) Calcula los gramos de óxido de hierro(III) que se obtendrán a partir de 2.3 moles sulfuro de hierro.
b) ¿Qué cantidad se necesita de oxígeno, con una pureza del 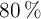 , para obtener 10 gramos de óxido de hierro(III)?
, para obtener 10 gramos de óxido de hierro(III)?
-
Masa de impurezas de un reactivo y volumen necesario del otro (5419)
El ácido sulfhídrico se forma por la reacción del no metal correspondiente con el hidrógeno molecular gaseoso.
a) Escribe la ecuación química que representa la reacción química descrita.
b) Si reaccionan 140 g del no metal, cuya pureza es de 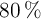 , calcula la masa de impurezas que no reaccionan y el volumen de hidrógeno, expresado en litros, que reaccionarán, medidos en condiciones normales.
, calcula la masa de impurezas que no reaccionan y el volumen de hidrógeno, expresado en litros, que reaccionarán, medidos en condiciones normales.
 Pureza
Pureza