-
PAU espontaneidad 0002
Dada la reacción: 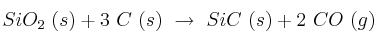
a) Halla la entalpía de la reacción .
b) Suponiendo que 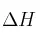 y
y 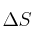 no varíen con la temperatura, ¿a partir de qué temperatura el proceso es espontáneo?
no varíen con la temperatura, ¿a partir de qué temperatura el proceso es espontáneo?
Datos: 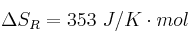 ;
; ![\Delta H^0_f[SiC(s)] = -65,3\ kJ/mol \Delta H^0_f[SiC(s)] = -65,3\ kJ/mol](local/cache-TeX/6095aa7f66621a8f0b4430e06ff5091e.png) ;
; ![\Delta H^0_f[SiO_2(s)] = -911\ kJ/mol \Delta H^0_f[SiO_2(s)] = -911\ kJ/mol](local/cache-TeX/895dfae339a8f1b86a560494f12b485b.png) ;
; ![\Delta H^0_f[CO(g)] = -111\ kJ/mol \Delta H^0_f[CO(g)] = -111\ kJ/mol](local/cache-TeX/092c6ca44e559b2ded936c2f2331c3cc.png)
-
PAU entalpía 0006
En un calorímetro, cuyo equivalente en agua es de 25 g, se vierten 100 mL de agua a 20 ºC. Se disuelven en ella 2 g de NaOH y se comprueba que la temperatura de la disolución es de 22 ºC. Calcula la entalpía de la disolución de NaOH en esas condiciones.
-
Ley de Hess: entalpía de formación del hexano (556)
Sabiendo que las entalpías estándar de combustión del hexano (l), del carbono (s) y del hidrógeno (g) son, respectivamente: -4 192 kJ/mol, -393.5 kJ/mol y -285.8 kJ/mol, calcula:
a) La entalpía de formación del hexano líquido en esas condiciones.
b) Los gramos de carbono consumidos en la formación del hexano cuando se han intercambiado 50 kJ.
-
PAU ley de Hess 0001
a) Escribe las ecuaciones de combustión del ácido butanoico, el hidrógeno y el carbón.
b) Indica cuáles de los reactivos o productos de esas reacciones tienen una entalpía de formación nula en condiciones estándar.
c) Aplicando la ley de Hess, explica cómo calcularías la entalpía de formación del ácido butanoico a partir de las entalpías de combustión de las reacciones del apartado a).
-
PAU entalpía 0005
La descomposición explosiva del trinitrotolueno 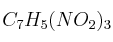 se puede expresar según:
se puede expresar según:
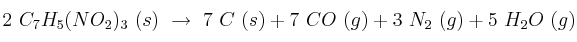
a) Halla la energía obtenida al descomponerse 1 kg de TNT.
b) Determina el volumen ocupado por los gases liberados en dicha descomposición, a presión atmosférica y a 500 ºC.
Datos: ![\Delta H^0_f[C_7H_5(NO_2)_3(s)] = -64,1\ kJ/mol \Delta H^0_f[C_7H_5(NO_2)_3(s)] = -64,1\ kJ/mol](local/cache-TeX/a98c721153dc3addc8105482e9a7138f.png) ;
; ![\Delta H^0_f[CO(g)] = -110,5\ kJ/mol \Delta H^0_f[CO(g)] = -110,5\ kJ/mol](local/cache-TeX/09ba8a60ad9cb82a43a37ba7bdeedb2a.png) ;
; ![\Delta H^0_f[H_2O(g)] = -241,8\ kJ/mol \Delta H^0_f[H_2O(g)] = -241,8\ kJ/mol](local/cache-TeX/121f649264d700ca0b3f070eca36e7dc.png) .
.
 Entalpía
Entalpía