-
Reacciones químicas: estequiometría, gases y reactivo limitante 0001
En un recipiente de vidrio de 20 L existe hidrógeno en c.n. Se introduce en él el nitrógeno que contiene un balón de 4 L a 5 atm y 27 ºC. La mezcla resultante queda a 10 ºC.
a) ¿Cuál será la presión de la mezcla resultante?
b) Si se hace reaccionar uno con otro para formar amoniaco, hasta que uno de ellos se acabe, ¿qué sobra y en qué cantidad?
c) ¿Cuál será la presión final, después de la reacción, si la temperatura se llevó a 27 ºC?
-
Estequiometría y reactivo limitante 0001
El cloruro de sodio reacciona con nitrato de plata precipitando totalmente cloruro de plata y obteniéndose además nitrato de sodio. Calcule:
a) La masa de cloruro de plata que se obtiene a partir de 100 mL de disolución de nitrato de plata 0,5 M y de 100 mL de disolución de cloruro de sodio 0,4 M.
b) Los gramos del reactivo en exceso.
Masas atómicas: O = 16; Na = 23; N = 14; Cl = 35,5; Ag = 108.
-
Reactivo limitante, reactivo sobrante y masa de producto (929)
En un reactor se introducen 76.2 g de 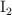 y 9.94 L de
y 9.94 L de 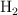 , medidos a 1 atm y
, medidos a 1 atm y 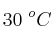 . Determina:
. Determina:
a) ¿Cuál es el reactivo limitante?
b) ¿Qué cantidad del otro reactivo queda sin reaccionar?
c) ¿Qué masa de HI se produce en la reacción?
Datos: H = 1 ; I = 127 ; 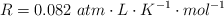
-
Cálculos en la reacción entre el agua oxigenada y el dióxido de azufre (795)
Cuando se hace reaccionar el dióxido de azufre con el agua oxigenada, se produce ácido sulfúrico, según la reacción:
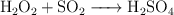
a) Determina los moles de ácido que se obtienen a partir de 12 L de  , medidos a 1 atm de presión y
, medidos a 1 atm de presión y 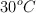 de temperatura, si reaccionan con agua oxigenada en exceso.
de temperatura, si reaccionan con agua oxigenada en exceso.
b) Los moles de ácido si los litros anteriores reaccionan con 10 g de 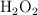
-
Masa de agua que se obtiene al mezclar masas distintas de hidrógeno y oxígeno (198)
Se hacen reaccionar 10 g de hidrógeno y 105 g de oxígeno para obtener agua. ¿Qué cantidad de agua será la que se obtenga?
Masas atómicas: H = 1 ; O = 16.
 Reactivo limitante
Reactivo limitante