-
Estequiometría: volumen de producto 0001
La oxidación del óxido de azufre (IV) da como resultado óxido de azufre (VI). ¿Qué volumen de éste se obtendrá, medido a 1 atm y 27 ºC, cuando se oxiden 100 g de dióxido de azufre con exceso de oxígeno?
-
Estequiometría y rendimiento de reacción 0001
¿Qué volumen de etileno, medido en condiciones normales, se puede obtener con 25 g de etanol puro, siendo la eficiencia de la reacción del 75 por ciento?
-
Reacción química: moles y volumen de hidrógeno gaseoso
El magnesio metálico reacciona con 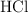 para producir hidrógeno gaseoso de acuerdo a la siguiente reacción:
para producir hidrógeno gaseoso de acuerdo a la siguiente reacción:

Si 2.15 g de magnesio reaccionan totalmente:
a) ¿Qué volumen de hidrógeno se puede producir a temperatura y presión estándar? (No tomar en cuenta la presión de vapor de agua)
b) ¿Cuál será el volumen si el gas está a 735 mm Hg y una temperatura de  ?
?
-
Relación estequiométrica con volúmenes y reactivo limitante 0001
En la reacción de formación de amoniaco (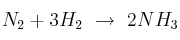 ), tenemos 50 litros de nitrógeno y 100 litros de hidrógeno,con P = 1 atm y T = 283 K. ¿Cuántos litros de amoniaco se obtienen?
), tenemos 50 litros de nitrógeno y 100 litros de hidrógeno,con P = 1 atm y T = 283 K. ¿Cuántos litros de amoniaco se obtienen?
-
Reacción química: reactivos gaseosos 0001
Se queman 20 L de sulfuro de hidrógeno en presencia de oxígeno para dar dióxido de azufre y agua. Escribe la reacción ajustada y determina el volumen de oxígeno necesario para quemar los 20 L de sulfuro de hidrógeno, suponiendo que la reacción se da en condiciones normales.
 Gases
Gases