-
Repaso: moles y estequiometría de la combustión del decano (6384)
En la combustión completa del hidrocarburo 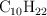 se produce dióxido de carbono y agua. La combustión del decano se representa mediante la siguiente reacción:
se produce dióxido de carbono y agua. La combustión del decano se representa mediante la siguiente reacción:

Si un recipiente contenía 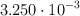 moles de decano y se hacen reaccionar:
moles de decano y se hacen reaccionar:
a) ¿Cuántos moles de 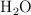 se producen?
se producen?
b) ¿Cuántos moles de  se necesitan?
se necesitan?
-
Porcentaje en masa de un componente en una mezcla que se hace reaccionar
Una muestra que contiene 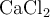 y
y  tiene una masa de 8.88 g y fue tratada a fin de precipitar todo el calcio como carbonato de calcio (
tiene una masa de 8.88 g y fue tratada a fin de precipitar todo el calcio como carbonato de calcio (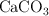 ) el cual fue posteriormente calentado y convertido en
) el cual fue posteriormente calentado y convertido en 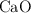 puro. La masa de
puro. La masa de 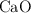 final formada fue de 1.12 g- Determina el
final formada fue de 1.12 g- Determina el 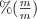 de
de 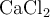 en la mezcla original.
en la mezcla original.
Masas moleculares (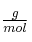 ):
): 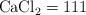 ;
; 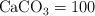 ;
; 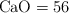 .
.
-
Masa de óxido de plata que se obtiene al oxidar plata metálica (6315)
El óxido de plata tiene un valor en el mercado superior a la plata natural. Para obtenerlo se hace reaccionar la plata con un compuesto con hidroxilo, dando lugar al óxido de plata y agua. Si hacemos reaccionar 2.353 kg de plata con 431 kg de ion hidroxilo, ¿qué cantidad de óxido de plata obtendré de dicha reacción?
Masas atómicas: Ag = 107.8 ; H = 1 ; O = 16.
-
Reacciones químicas: reactivo limitante, impurezas y rendimiento de reacción (6294)
En el laboratorio se puede producir 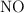 gaseoso haciendo reaccionar cobre metálico con ácido nítrico diluido, según la siguiente ecuación química:
gaseoso haciendo reaccionar cobre metálico con ácido nítrico diluido, según la siguiente ecuación química:
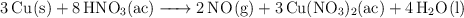
a) Indica cuál es el agente oxidante en esta reacción redox.
b) ¿Qué volumen de ese gas, a 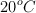 y 750 mm Hg, se puede preparar a partir de 35 g de cobre y 0.6 moles de ácido nítrico? Considera comportamiento de gas ideal para el óxido de nitrógeno.
y 750 mm Hg, se puede preparar a partir de 35 g de cobre y 0.6 moles de ácido nítrico? Considera comportamiento de gas ideal para el óxido de nitrógeno.
c) ¿Cuál sería ese volumen si el cobre a emplear contuviera un 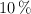 en peso de impurezas no reactivas y se supiera que el rendimiento máximo de la técnica es del
en peso de impurezas no reactivas y se supiera que el rendimiento máximo de la técnica es del 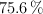 ?
?
Datos: Cu = 63.5 ; 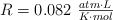
-
Refuerzo: masa de cobre al reaccionar hidrógeno y óxido de cobre(II) (6267)
Calcula la cantidad de cobre que se produce al reaccionar 400 mL de dihidrógeno, en condiciones normales, con un exceso de óxido de cobre(II). Los productos de la reacción son cobre y agua.
Considera la masa atómica del cobre como 63.5 g/mol.
 Reacciones químicas
Reacciones químicas