-
Aplicación Principio Le Chatelier 0001
Supón el siguiente sistema en equilibrio: 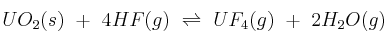 . Explica hacia dónde se desplaza el equilibrio cuando:
. Explica hacia dónde se desplaza el equilibrio cuando:
a) Se adiciona 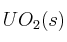 al sistema.
al sistema.
b) Se elimina HF(g).
c) Se aumenta la capacidad del recipiente de reacción.
-
Constantes de equilibrio: Dependencia de la temperatura 0001
A 613 K, el valor de  para la reacción:
para la reacción: 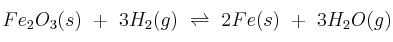 es 0,064. Si en el equilibrio anterior la presión parcial del hidrógeno es una atmósfera, calcula:
es 0,064. Si en el equilibrio anterior la presión parcial del hidrógeno es una atmósfera, calcula:
a) La concentración de hidrógeno.
b) La presión total.
-
Selectividad junio 2012: equilibrio químico, Kc y Kp
En una vasija de 10 L mantenida a 270 ºC y previamente evacuada se introducen 2,5 moles de pentacloruro de fósforo y se cierra herméticamente. La presión en el interior comienza entonces a elevarse debido a la disociación térmica del pentacloruro: 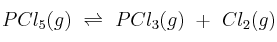 . Cuando se alcanza el equilibrio la presión es de 15,6 atm.
. Cuando se alcanza el equilibrio la presión es de 15,6 atm.
a) Calcula el número de moles de cada especie en el equilibrio.
b) Obtén los valores de 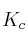 y
y  .
.
Dato: 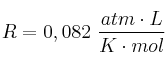
-
Constante de equilibrio y Principio de Le Chatelier 0003
La descomposición del pentaóxido de dinitrógeno se puede describir como: 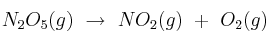
a) Escribe las expresiones de  y
y  .
.
b) ¿Explica cómo evoluciona el equilibrio si se aumenta la presión del sistema?
c) ¿Cómo afectaría al equilibrio un aumento de la concentración de oxígeno? ¿Y al valor de  ?
?
-
UNED: Equilibrio químico y cálculo de Kc
A una temperatura próxima a los 400 ºC se mezclan 0,062 mol de 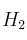 y 0,042 mol de
y 0,042 mol de 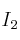 . Al establecerse el equilibrio se forman 0,076 mol de HI. Calcular:
. Al establecerse el equilibrio se forman 0,076 mol de HI. Calcular:
a) La constante de equilibrio  .
.
b) El número de mol de HI que se formará al mezclar, a la misma temperatura, 0,08 mol de 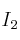 con 0,08 mol de
con 0,08 mol de 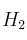 .
.
 Constante equilibrio
Constante equilibrio