-
EBAU Andalucía: física (junio 2010) - ejercicio A.4 (1486)
Al iluminar potasio con luz amarilla de sodio de 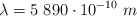 se liberan electrones con una energía cinética máxima de
se liberan electrones con una energía cinética máxima de 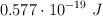 y al iluminarlo con luz ultravioleta de una lámpara de mercurio de
y al iluminarlo con luz ultravioleta de una lámpara de mercurio de 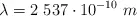 , la energía cinética máxima de los electrones emitidos es
, la energía cinética máxima de los electrones emitidos es 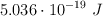 .
.
a) Explica el fenómeno descrito en términos energéticos y determina el valor de la constante de Planck.
b) Calcula el valor del trabajo de extracción del potasio.
Dato: 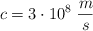
-
EBAU Andalucía: física (junio 2010) - ejercicio A.3 (1485)
Una espira circular de 5 cm de radio, inicialmente horizontal, gira a 60 rpm en torno a uno de sus diámetros en un campo magnético vertical de 0.2 T.
a) Dibuje en una gráfica el flujo magnético a través de la espira en función del tiempo entre los instantes t = 0 s y t = 2 s e indique el valor máximo de dicho flujo.
b) Escriba la expresión de la fuerza electromotriz inducida en la espira en función del tiempo e indique su valor en el instante t = 1 s.
-
EBAU Andalucía: física (junio 2010) - ejercicio A.1 (1483)
a) Explica qué se entiende por velocidad de escape y deduce razonadamente su expresión.
b) Razona qué energía habría que comunicar a un objeto de masa m, situado a una altura h sobre la superficie de la Tierra, para que se alejara indefinidamente de ella.
-
Constante de equilibrio y Principio de Le Chatelier 0002
En un matraz de 20 L, a 25 ºC, se encuentran en equilibrio 2,14 moles de 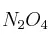 y 0,50 moles de
y 0,50 moles de 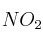 según:
según: 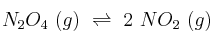
a) Calcule el valor de las constantes 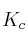 y
y 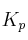 a esa temperatura.
a esa temperatura.
b) ¿Cuál es la concentración de 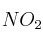 cuando se restablece el equilibrio después de introducir dos moles adicionales de
cuando se restablece el equilibrio después de introducir dos moles adicionales de 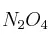 , a la misma temperatura?
, a la misma temperatura?
Dato: R = 0,082 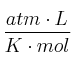
-
EBAU Andalucía: química (septiembre 2010) - ejercicio B.5 (1481)
Considera la reacción de hidrogenación del propino:
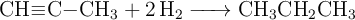
a) Calcula la entalpía de la reacción, a partir de las entalpías medias de enlace.
b) Determina la cantidad de energía que habrá que proporcionar a 100 g de hidrógeno molecular para disociarlo completamente en sus átomos.
Datos: Entalpías de enlace en kJ/mol: (C−C) = 347; (C≡C) = 830; (C−H) = 415; (H−H) = 436.
Masa atómica: H = 1.
 RESUELTO
RESUELTO