-
Comprobar si se cumple la Ley de Conservación de la Masa (5522)
Explica si la reacción  cumple con la ley de la Conservación de la Masa. En caso negativo, ¿cómo podríamos conseguir que sí la cumpliese?
cumple con la ley de la Conservación de la Masa. En caso negativo, ¿cómo podríamos conseguir que sí la cumpliese?
-
Reactivo limitante y masa de producto a partir de reactivos impuros (5499)
La siguiente es una reacción espontánea del aluminio metálico con bromo, un no metal líquido. La ecuación es la siguiente:
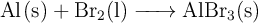
a) Si se hicieron reaccionar 12 g de aluminio (al 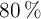 de pureza) y 56 g de bromo (al
de pureza) y 56 g de bromo (al 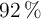 de pureza), ¿cuál es la sustancia que actúa como reactivo limitante?
de pureza), ¿cuál es la sustancia que actúa como reactivo limitante?
b) ¿Cuántos gramos de bromuro de aluminio se producen si el rendimiento de la reacción es del 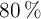 ?
?
Masas atómicas: Al = 27 y Br = 80.
-
Obtención de óxido de hierro(III) a partir de sulfuro de hierro(II) (4716)
Para la obtención de óxido de hierro(III), según la siguiente reacción:
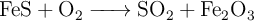
a) Calcula los gramos de óxido de hierro(III) que se obtendrán a partir de 2.3 moles sulfuro de hierro.
b) ¿Qué cantidad se necesita de oxígeno, con una pureza del 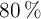 , para obtener 10 gramos de óxido de hierro(III)?
, para obtener 10 gramos de óxido de hierro(III)?
-
Moles de amoniaco que se obtienen a partir de una masa de nitrógeno (4712)
Con setenta gramos de 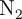 , ¿cuántos moles de
, ¿cuántos moles de 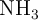 se van a producir, si el hidrógeno necesario para la reacción está en exceso?
se van a producir, si el hidrógeno necesario para la reacción está en exceso?
-
Reacción formación del K2O: reactivo limintante y producto formado (5405)
Si usamos 50 g de potasio y 45 g de oxígeno para reaccionar y formar óxido de potasio:
a) ¿Cuánto producto se forma?
b) ¿Qué reactivo sobra y en qué cantidad?
c) ¿Qué masa del otro reactivo sería necesaria para que reaccionara la totalidad de los reactivos?
Masas atómicas: K = 39 ; O = 16
 Ajuste
Ajuste