-
Estequiometría con reactivos gaseosos 0001
En la formación de esmog los gases nitrógeno y oxígeno reaccionan para formar dióxido de nitrógeno. ¿Cuántos gramos de 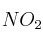 se producirán cuando reaccionen completamente 2,0 litros de nitrógeno a 840 mm Hg y a
se producirán cuando reaccionen completamente 2,0 litros de nitrógeno a 840 mm Hg y a 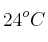 ?
?
-
Volumen de gas producido en una reacción química 0001
Al combinar 20 g de zinc con ácido clorhídrico para dar cloruro de zinc e hidrógeno. ¿Cuál es el volumen, en litros, de hidrógeno que se obtiene, medido en condiciones normales?
-
Estequiometría de la reacción entre cinc y ácido sulfúrico (2351)
Se tratan 4.9 g de ácido sulfúrico con cinc. En la reacción se obtiene sulfato de cinc e hidrógeno.
a) Formula y ajusta la reacción que tiene lugar.
b) Calcular la cantidad de hidrógeno desprendido.
c) Halla qué volumen ocupará ese hidrógeno en condiciones normales.
-
Masa de cinc que reacciona a partir del volumen de hidrógeno (2375)
Una muestra de zinc metálico reacciona completamente con un exceso de ácido clorhídrico según la reacción:

El hidrógeno gaseoso generado se recoge sobre agua a 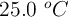 . El volumen del gas es de 7.80 L y la presión es 0.98 atm. Calcula el número de gramos de zinc consumidos en la reacción. (La presión del vapor de agua a
. El volumen del gas es de 7.80 L y la presión es 0.98 atm. Calcula el número de gramos de zinc consumidos en la reacción. (La presión del vapor de agua a 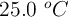 es de 23.8 mm Hg).
es de 23.8 mm Hg).
-
Reacciones químicas: estequiometría, moles y volumen de gases (2179)
Calcular el volumen de 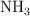 en litros, a 530 K y a una presión de 3.10 atm, que se obtendría si se hacen reaccionar 41 g de
en litros, a 530 K y a una presión de 3.10 atm, que se obtendría si se hacen reaccionar 41 g de 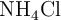 al
al 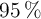 de pureza con suficiente
de pureza con suficiente 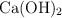 .
.
 Gases
Gases