-
Equilibrio químico: moles en el equilibrio 0001
A cierta temperatura se introducen en un recipiente 0,2 moles de 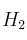 y 0,2 moles de
y 0,2 moles de 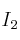 . Si la constante de equilibrio de la reacción:
. Si la constante de equilibrio de la reacción: 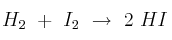 , a esa temperatura vale 4. Determina los moles de cada especie química en el equilibrio.
, a esa temperatura vale 4. Determina los moles de cada especie química en el equilibrio.
-
Equilibrio químico: Concentraciones en el equilibrio 0001
Si se introducen 0,100 moles de 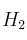 y 0,100 moles de
y 0,100 moles de 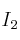 en un matraz de 10,0 L a 698 K. ¿Cuáles serán las concentraciones de equilibrio de
en un matraz de 10,0 L a 698 K. ¿Cuáles serán las concentraciones de equilibrio de 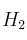 ,
, 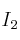 y HI?
y HI?  = 54,4 a 698 K.
= 54,4 a 698 K.
-
Constante de equilibrio y Principio de Le Chatelier 0002
En un matraz de 20 L, a 25 ºC, se encuentran en equilibrio 2,14 moles de 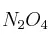 y 0,50 moles de
y 0,50 moles de 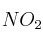 según:
según: 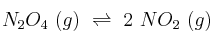
a) Calcule el valor de las constantes 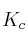 y
y 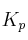 a esa temperatura.
a esa temperatura.
b) ¿Cuál es la concentración de 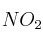 cuando se restablece el equilibrio después de introducir dos moles adicionales de
cuando se restablece el equilibrio después de introducir dos moles adicionales de 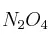 , a la misma temperatura?
, a la misma temperatura?
Dato: R = 0,082 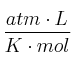
-
Constante de equilibrio y Principio de Le Chatelier 0001
En un recipiente cerrado se establece el siguiente equilibrio:
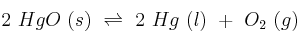 ;
; 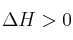
a) Escriba las expresiones de las constantes 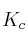 y
y 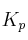 .
.
b) ¿Cómo afecta al equilibrio un aumento de la presión parcial de oxígeno?
c) ¿Qué le ocurrirá al equilibrio cuando se aumente la temperatura?
-
EBAU Andalucía: química (junio 2011) - ejercicio B.6 (1470)
En un recipiente de 2 L se introducen 2.1 mol de  y 1.6 mol de
y 1.6 mol de 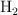 y se calienta a
y se calienta a 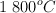 . Una vez alcanzado el siguiente equilibrio:
. Una vez alcanzado el siguiente equilibrio:

se analiza la mezcla y se encuentra que hay 0.9 mol de  . Calcula:
. Calcula:
a) La concentración de cada especie en el equilibrio.
b) El valor de las constantes  y
y  a esa temperatura.
a esa temperatura.
 Constante equilibrio
Constante equilibrio