-
Constante de disociación y pH 0002
A 25 ºC, la constante del equilibrio: 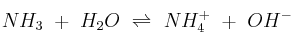 es
es 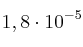 . Se añaden 7 gramos de amoniaco a la cantidad de agua necesaria para obtener 500 mL de disolución.
. Se añaden 7 gramos de amoniaco a la cantidad de agua necesaria para obtener 500 mL de disolución.
a) Calcula el pH de la disolución.
b) Calcula el grado de disociación del amoniaco.
Masas atómicas: H = 1; N = 14
-
Concentraciones en equilibrio y pH 0001
En 500 mL de una disolución acuosa 0,1 M de NaOH:
a) ¿Cuál es la concentración de iones 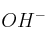 ?
?
b) ¿Cuál es la concentración de iones 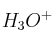 ?
?
c) ¿Cuál es el pH?
-
Preparación disolución y pH 0001
a) Calcula los gramos de NaOH que se necesitan para preparar 250 mL de una disolución acuosa de pH = 13.
b) Describe el material necesario y el procedimiento a seguir para preparar la disolución de NaOH.
Masas atómicas: H = 1; O = 16; Na = 23.
-
Equilibrio ácido-base: Aplicación Le Chatelier 0001
a) Escribe el equilibrio de hidrólisis del ion amonio (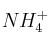 ), identificando en el mismo las especies que actúan como ácido o como base de Brönsted.
), identificando en el mismo las especies que actúan como ácido o como base de Brönsted.
b) Razona cómo variará la concentración de ion amonio al añadir una disolución de NaOH .
c) Razona cómo variará la concentración de ion amonio al añadir una disolución de HCl .
-
Constante de disociación y pH 0001
A 15 g de ácido acético (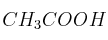 ) se añade la cantidad suficiente de agua para obtener 500 mL de disolución. Calcula:
) se añade la cantidad suficiente de agua para obtener 500 mL de disolución. Calcula:
a) El pH de la disolución que resulta.
b) El grado de disociación del ácido acético.
Datos: 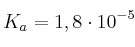 : Masas atómicas: H = 1; C = 12; O = 16
: Masas atómicas: H = 1; C = 12; O = 16
 Ácidos y bases
Ácidos y bases