-
Constante de equilibrio de la reacción inversa a una reacción (177)
La constante de equilibrio  de la reacción:
de la reacción:

a 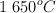 es 4.2. Determina la constante de equilibrio
es 4.2. Determina la constante de equilibrio 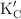 de la reacción:
de la reacción:

Razona tu respuesta, escribiendo la expresión de las constantes de equilibrio en cada caso.
-
Configuración electrónica: Aplicación de los principios de Pauli y de Hund (176)
Dadas las configuraciones electrónicas: 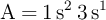 ;
; 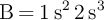 ;
; 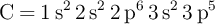 y
y 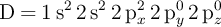 , indica razonadamente:
, indica razonadamente:
a) La que no cumple el principio de exclusión de Pauli.
b) La que no cumple el principio de máxima multiplicidad de Hund.
c) La que, siendo permitida y correspondiente a un estado fundamental, contiene electrones desapareados.
-
Moles, moléculas y átomos en una masa de oxígeno (174)
Calcula cuántas moléculas, moles y átomos hay en 64 g de oxígeno gaseoso. (Masa atómica del oxígeno = 16).
-
Leyes ponderales: Proust y Lavoisier (173)
En la combustión de 120 g de carbono con oxígeno en exceso se forman 440 g de un óxido de carbono. Determina:
a) Los gramos de oxígeno que han reaccionado.
b) Los gramos del mismo óxido que se formarían a partir de 24 g de carbono y 32 g de oxígeno.
-
Ternas de números cuánticos que son posibles (172)
Indicar cuál o cuáles de los siguientes grupos de tres valores correspondientes a n, l y m son permitidos:
a) (3, -1, 1)
b) (2, 1, 3)
c) (4, 2, 0)
d) (0, 0, 0)
e) (3, 1, 1)
f) (5, 3, -3)
 RESUELTO
RESUELTO