-
Problema neutralización ácido-base 0005
Calcula la constante de equilibrio de la reacción de neutralización del ácido acético con NaOH.
Dato: 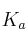 (ác. acético) =
(ác. acético) = 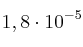
-
Problema equilibrio químico 0016
En un recipiente de 3 L se introducen 0,60 moles de 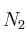 y 0,36 moles de
y 0,36 moles de 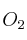 . Calentamos el recipiente hasta los 650 ºC y se establece el equilibrio:
. Calentamos el recipiente hasta los 650 ºC y se establece el equilibrio:
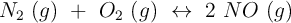
En estas condiciones reacciona el 5,3 del nitrógeno existente. Calcula el valor de
del nitrógeno existente. Calcula el valor de  a esa temperatura y la presión total en el recipiente cuando se ha alcanzado el equilibrio.
a esa temperatura y la presión total en el recipiente cuando se ha alcanzado el equilibrio.
-
UNED equilibrio químico 0002
En un recipiente se introducen 2,94 moles de yodo y 8,10 moles de hidrógeno, estableciéndose el equilibrio cuando se han formado 5,60 moles de yoduro de hidrógeno. A la temperatura de la experiencia todas las sustancias son gaseosas. Calcular: a) Las cantidades de yodo e hidrógeno que han reaccionado; b) La constante de equilibrio de la reacción.
-
UNED equilibrio químico 0001
Una mezcla gaseosa de 1 L, constituida inicialmente por 7,94 moles de hidrogeno y 5,30 moles de yodo, se calienta a 445 ºC, con lo que se forman en el equilibrio 9,52 moles de HI. a) Ajustar la reacción; b) calcular el valor de la constante de equilibrio a dicha temperatura; c) si hubiésemos partido de 4 moles de hidrógeno gas y 2 moles de yodo gas, ¿cuántos moles de yoduro de hidrógeno habría en el equilibrio? Razone sus respuestas.
-
EBAU Andalucía: química (junio 2010) - ejercicio B.5 (1044)
En un recipiente de 1 litro de capacidad, en el que previamente se ha hecho el vacío, se introducen 0.1 mol de 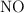 , 0.05 moles de
, 0.05 moles de 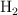 y 0.1 mol de agua. Se calienta el matraz y se establece el equilibrio:
y 0.1 mol de agua. Se calienta el matraz y se establece el equilibrio:

Sabiendo que cuando se establece el equilibrio la concentración de 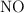 es 0.062 M, calcula:
es 0.062 M, calcula:
a) La concentración de todas las especies en el equilibrio.
b) El valor de la constante  a esa temperatura.
a esa temperatura.
 Constante equilibrio
Constante equilibrio