-
Problema entalpía 0003
A 25 ºC el nitrógeno reacciona con el oxígeno para formar dióxido de nitrógeno según el siguiente proceso: 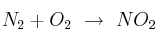 absorbiendo 8 030 cal/mol.
absorbiendo 8 030 cal/mol.
a) Escribe la ecuación termoquímica del proceso.
b) ¿Qué energía absorberá el sistema por cada mol de dióxido de nitrógeno que se obtenga?
c) ¿Cuántos julios se absorben en la obtención de 500 g de dióxido de nitrógeno?
(Datos: N = 14 ; O = 16 ; 1 cal = 4,18 J)
-
Energía que se intercambia cuando se descompone una masa de agua oxigenada (207)
El agua oxigenada se descompone según la reacción:
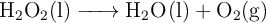
Si el balance energético para este proceso es de -196 kJ/mol:
a) Escribe la ecuación termoquímica del proceso.
b) Calcula la energía intercambiada en la descomposición de 24 g de 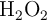 .
.
-
Problema entalpía 0001
Un método muy usado en la industria para obtener el tetracloruro de carbono es:
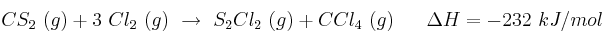
Calcula el calor que se desprende en la obtención de 100 g de tetracloruro de carbono.
-
Selectividad Andalucía: química (junio 2009) - problema 2.A (115)
Calcula:
a) La entalpía de combustión estándar del octano líquido, sabiendo que se forman 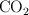 y
y 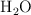 gaseosos como productos.
gaseosos como productos.
b) La energía que necesita un automóvil por cada kilómetro si consume 5 L de octano por cada 100 km recorridos.
Datos: ![\Delta H^0_f[\ce{H2O(g)}] = -241.8\ kJ/mol \Delta H^0_f[\ce{H2O(g)}] = -241.8\ kJ/mol](local/cache-TeX/8bf6ae301136ac47d5b0af58a895e485.png) ;
; ![\Delta H^0_f[\ce{CO2(g)}] = -393.5\ kJ/mol \Delta H^0_f[\ce{CO2(g)}] = -393.5\ kJ/mol](local/cache-TeX/507231c248149d1e5de1f57fa798c287.png) ;
; ![\Delta H^0_f[\ce{C8H18(l)}] = -250.0\ kJ/mol \Delta H^0_f[\ce{C8H18(l)}] = -250.0\ kJ/mol](local/cache-TeX/8f58189df464072507156c529877a203.png) . Densidad del octano líquido
. Densidad del octano líquido 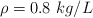 . Masas atómicas: C =12 ; H = 1.
. Masas atómicas: C =12 ; H = 1.
-
Entalpía de reacción y energía liberada en la descomposición de caliza (10)
El carbonato de calcio se descompone térmicamente produciendo óxido de calcio y dióxido de carbono. Calcula la entalpía de reacción del proceso y qué cantidad de energía irá asociada a la descomposición térmica de 2.5 kg de caliza que tiene una riqueza del 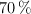 en carbonato de calcio.
en carbonato de calcio.
Datos: Ca = 40 ; C = 12 ; O = 16 ; 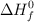 (óxido de calcio) =
(óxido de calcio) = 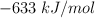 ;
; 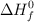 (dióxido de carbono) =
(dióxido de carbono) = 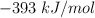 ;
; 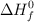 (carbonato de calcio) =
(carbonato de calcio) = 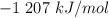 .
.
 Entalpía
Entalpía