-
Compuestos iónicos: Puntos de fusión 0001
La tabla que sigue corresponde a los puntos de fusión de distintos sólidos iónicos:
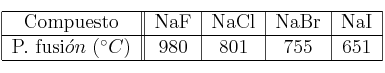
Considerando los valores anteriores: a) Indica cómo variará la energía reticular en este grupo de compuestos; b) Razona cuál es la causa de esa variación.
-
Ciclo de Born-Haber y energía reticular (1852)
a) Haz un esquema del ciclo de Born-Haber para el NaCl.
b) Calcula la energía reticular del NaCl(s), a partir de los siguientes datos:
– Entalpía de sublimación del sodio = 108 kJ/mol
– Entalpía de disociación del cloro = 243.2 kJ/mol
– Entalpía de ionización del sodio = 495.7 kJ/mol
– Afinidad electrónica del cloro = -348 kJ/mol
– Entalpía de formación del cloruro de sodio = -401.8 kJ/mol
-
Enlace iónico: ciclo de Born-Haber 0002
Diseña el ciclo de Born-Haber para calcular la energía reticular del 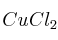 a partir del cobre metálico y del cloro gaseoso. Indica todas las magnitudes que serían necesarias para hacer el cálculo.
a partir del cobre metálico y del cloro gaseoso. Indica todas las magnitudes que serían necesarias para hacer el cálculo.
-
Enlace iónico: Ciclo de Born-Haber 0001
Dibuja el ciclo de Born-Haber para la formación del cloruro de calcio y expresa la energía reticular en función del resto de energías presentes en dicho ciclo.
-
EBAU Andalucía: química (junio 2010) - ejercicio A.2 (1035)
Supongamos que los sólidos cristalinos NaF, KF y LiF cristalizan en el mismo tipo de red.
a) Escribe el ciclo de Born-Haber para el NaF.
b) Razona cómo varía la energía reticular de las sales mencionadas.
c) Razona cómo varían las temperaturas de fusión de las citadas sales.
 Energía reticular
Energía reticular