-
Energía de activación de una reacción de orden uno y constante de velocidad (6164)
Para la reacción irreversible de primer orden:
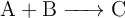
se sabe que la velocidad se hace cuatro veces mayor cuando aumenta la temperatura de 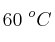 a
a 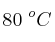 . Teniendo en cuenta que la constante de velocidad a
. Teniendo en cuenta que la constante de velocidad a 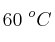 para dicha reacción es
para dicha reacción es 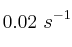 , determina:
, determina:
a) La energía de activación de la reacción (expresada en kJ/mol).
b) La constante de velocidad cuando la reacción se lleva a cabo a 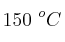 .
.
-
Presión total de un sistema gaseoso después de una hora (4811)
El reactivo A se descompone según la reacción: 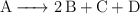 , siendo una reacción homogénena en fase gaseosa. Se tiene un mol de A en un recipiente de 2 L a
, siendo una reacción homogénena en fase gaseosa. Se tiene un mol de A en un recipiente de 2 L a 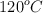 . Halla la presión total del recipiente al cabo de una hora a partir de los datos de la tabla siguiente:
. Halla la presión total del recipiente al cabo de una hora a partir de los datos de la tabla siguiente:

-
Cuestión cinética química 0008
Las energías de activación para tres reacciones distintas son: 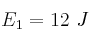 ;
; 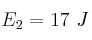 y
y 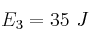 . Indica cuál de las tres reacciones es la más rápida y razona qué efecto tendrá en cada una de ellas un aumento de la temperatura.
. Indica cuál de las tres reacciones es la más rápida y razona qué efecto tendrá en cada una de ellas un aumento de la temperatura.
-
Problema cinética química 0005
A 600 K, el valor de la constante de velocidad de la descomposición de una sustancia A es 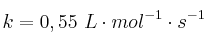 :
:
a) ¿Cuál es la velocidad de descomposición de la sustancia a esta temperatura si ![[A] = 3\cdot 10^{-3}\ mol/L [A] = 3\cdot 10^{-3}\ mol/L](local/cache-TeX/f726b654245ff6e2e567329fc1a0c7d7.png) ?
?
b) Si a 625 K la constante de velocidad es 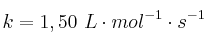 , ¿cuánto vale la energía de activación?
, ¿cuánto vale la energía de activación?
c) Fijándote en las unidades de la constante, ¿serías capaz de decir cuál es el orden de reacción de la descomposición de A?
-
Problema cinética química 0004
A 20 ºC la constante de velocidad de un proceso de descomposición de una sustancia es 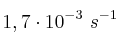 , mientras que su valor a 35 ºC es
, mientras que su valor a 35 ºC es 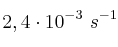 . ¿Cuál es la energía de activación del proceso? ¿Podemos asegurar que el orden total de la reacción es uno?
. ¿Cuál es la energía de activación del proceso? ¿Podemos asegurar que el orden total de la reacción es uno?
 Arrhenius
Arrhenius