-
Moles, moléculas y átomos contenidos en un metro cúbico de metano (8156)
En 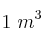 de metano (
de metano (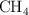 ), medido en condiciones normales de presión y temperatura, calcula:
), medido en condiciones normales de presión y temperatura, calcula:
a) El número de moles de metano.
b) El número de moléculas de metano.
c) El número de átomos de hidrógeno.
-
Densidad de un líquido a partir de su volumen molar (7884)
El volumen molar del 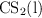 a
a 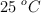 es de
es de 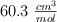 . Calcula su densidad a esa temperatura.
. Calcula su densidad a esa temperatura.
-
Ampliación: estequiometría, gases y composición centesimal (7360)
Se tratan 10.0 g de un mineral de aluminio que contiene una pureza del 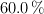 , con 50.0 mL de una solución acuosa 0.150 M de ácido sulfúrico. Los productos de esta reacción son hidrógeno gaseoso y tris-tetraoxidosulfato de dialuminio.
, con 50.0 mL de una solución acuosa 0.150 M de ácido sulfúrico. Los productos de esta reacción son hidrógeno gaseoso y tris-tetraoxidosulfato de dialuminio.
a) Escribe la ecuación química de la reacción.
b) ¿Qué volumen de hidrógeno se obtendrá, medido en condiciones normales de presión y temperatura?
c) Determina la composición centesimal del tris-tetraoxidosulfato de dialuminio.
-
Repaso: caso práctico de materia y reacciones químicas (7296)
Cuando el cinc, cuyo número atómico es 30 y tiene 35 neutrones en su núcleo, reacciona con el cloruro de hidrógeno, siendo la masa atómica del hidrógeno 1 u y teniendo el cloro 17 protones y 18 neutrones, se forman cloruro de cinc e hidrógeno gaseoso. Responde a las siguientes cuestiones:
a) Escribe la ecuación química que tiene lugar.
b) Si reaccionan 36 g del compuesto covalente con exceso del metal, ¿qué masa del compuesto iónico se obtiene?
c) ¿Qué volumen de gas se obtendrá, medido en condiciones normales, si se hacen reaccionar 50 g de metal puro con exceso de clorano?
d) ¿Cuál sería la masa de gas que se obtendría en el apartado b) si el isótopo del cloro usado fuese el 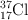 ? ¿Cuántos protones y neutrones presenta este isótopo?
? ¿Cuántos protones y neutrones presenta este isótopo?
e) ¿Cuántas moléculas y cuántos átomos de hidrógeno estarán contenidos en el volumen del apartado c)?
-
Volumen, moléculas y átomos que contiene una masa de N2O (7291)
Para 6.30 g de 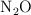 en condiciones normales de presión y temperatura:
en condiciones normales de presión y temperatura:
a) Calcula el volumen que ocuparían, expresado en litros.
b) Calcula la cantidad de moléculas que contienen.
c) Calcula la cantidad de átomos de nitrógeno que contienen.
Masas atómicas relativas: N = 14 y O = 16.
 Volumen molar
Volumen molar