-
Volumen de disolución de ácido sulfúrico necesario para una reacción (7950)
Dada la reacción:
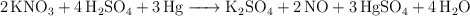
Si se colocan en el recipiente de la reacción 7.0 g de una muestra mineral, que contiene un 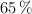 en masa de
en masa de 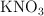 , con 17 g de mercurio y acido sulfúrico 12 M, de densidad
, con 17 g de mercurio y acido sulfúrico 12 M, de densidad 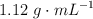 . Calcula el volumen mínimo de acido sulfúrico que será necesario emplear.
. Calcula el volumen mínimo de acido sulfúrico que será necesario emplear.
Masas atómicas: K = 39 ; N = 14 ; O = 16 ; Hg = 200.6 ; S = 32 ; H = 1.
-
Masa de clorato de potasio necesaria para obtener una masa de oxígeno (7768)
¿Cuántos gramos de clorato de potasio (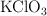 ) se tienen que descomponer para obtener 367.8 g de
) se tienen que descomponer para obtener 367.8 g de  ? ¿Qué masa de cloruro de potasio se formará?
? ¿Qué masa de cloruro de potasio se formará?
Datos: K = 39 ; Cl = 35.5 ; O = 16.
-
Repaso: caso práctico de materia y reacciones químicas (7296)
Cuando el cinc, cuyo número atómico es 30 y tiene 35 neutrones en su núcleo, reacciona con el cloruro de hidrógeno, siendo la masa atómica del hidrógeno 1 u y teniendo el cloro 17 protones y 18 neutrones, se forman cloruro de cinc e hidrógeno gaseoso. Responde a las siguientes cuestiones:
a) Escribe la ecuación química que tiene lugar.
b) Si reaccionan 36 g del compuesto covalente con exceso del metal, ¿qué masa del compuesto iónico se obtiene?
c) ¿Qué volumen de gas se obtendrá, medido en condiciones normales, si se hacen reaccionar 50 g de metal puro con exceso de clorano?
d) ¿Cuál sería la masa de gas que se obtendría en el apartado b) si el isótopo del cloro usado fuese el 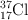 ? ¿Cuántos protones y neutrones presenta este isótopo?
? ¿Cuántos protones y neutrones presenta este isótopo?
e) ¿Cuántas moléculas y cuántos átomos de hidrógeno estarán contenidos en el volumen del apartado c)?
-
Refuerzo: composición porcentual de los productos de una combustión (7166)
Una muestra de butanol se hace reaccionar con oxígeno en exceso según la reacción:

Se forman 78 g de dióxido de carbono y una cantidad de agua desconocida. Calcula la composición porcentual de la mezcla de productos.
-
Estequiometría de la combustión del butanol (7077)
Dada la reacción de combustión del butanol:

a) Balancea la ecuación y establece la relación estequiométrica en moles.
b) Calcula las masas moleculares de todas las sustancias y establece la relación másica.
Si se hacen reaccionar 200g de 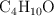 con 400 g de
con 400 g de  :
:
c) Determina cuál es el reactivo limitante y cuántos moles de  se necesitan para obtener 50 L de
se necesitan para obtener 50 L de  en condiciones normales de P y T.
en condiciones normales de P y T.
 Relación másica
Relación másica