-
Reacción redox entre una aleación de cobre y ácido nítrico (6127)
Cuando se hacen reaccionar 200 g de una aleación, que contiene cobre en un 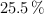 , con 180 mL de una disolución de ácido nítrico al
, con 180 mL de una disolución de ácido nítrico al 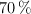 en masa y densidad 1.41 g/mL, se obtienen como productos de reacción óxido de nitrógeno(II), nitrato de cobre(II) y agua con un rendimiento del
en masa y densidad 1.41 g/mL, se obtienen como productos de reacción óxido de nitrógeno(II), nitrato de cobre(II) y agua con un rendimiento del 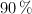 .
.
a) Ajusta la reacción que tiene lugar empleando el método del ion-electrón, indica cuál es el agente oxidante y el agente reductor, así como los estados de oxidación de las especies oxidadas y reducidas.
b) Calcula los gramos de nitrato de cobre(II) que se obtienen.
c) Si el óxido de nitrógeno(II) se recoge sobre agua a 293 K y 1 atm, calcula el volumen recogido.
Masas atómicas: Cu = 63.5 ; N = 14 ; O = 16 ; H = 1.
-
Proceso redox: oxidante y reductor en una reacción
En la ecuación: 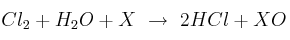
¿Cuál de las siguientes afirmaciones es correcta?
a) X es el agente oxidante.
b) X es oxidado directamente por el agua.
c) El agua es el verdadero agente oxidante.
d) El cloro es el verdadero agente oxidante.
e) El cloro es el agente reductor.
-
Verdadero o falso sobre un proceso redox (5421)
Indica si las siguientes afirmaciones son verdaderas o falsas en relación al siguiente proceso:
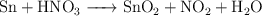
a) El estaño se oxida.
b) El ácido nítrico es el agente oxidante.
c) La forma reducida es el dióxido de nitrógeno.
d) El coeficiente del agente reductor es 4.
-
Número de oxidación del azufre en el ión sulfato (4705)
¿Cuál es el número de oxidación del azufre en el anión sultafo 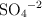 ?
?
-
Número de oxidación del carbono en compuesto orgánico 0001
¿Cuál es el número de oxidación del carbono en el compuesto 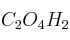 ?
?
 Número de oxidación
Número de oxidación