-
Ley de Hess para obtener la entalpía de formación de la sacarosa (273)
La entalpía de combustión de la sacarosa (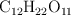 ) es
) es 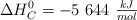 . Calcula su entalpía de formación a partir de los siguientes datos:
. Calcula su entalpía de formación a partir de los siguientes datos:
![\Delta H_f^0[\ce{CO2(g)}] = -393.5\ \textstyle{kJ\over mol} \Delta H_f^0[\ce{CO2(g)}] = -393.5\ \textstyle{kJ\over mol}](local/cache-TeX/f29ba749234bd7fb092e329e1d01a34d.png) ;
; ![\Delta H_f^0[\ce{H2O(l)}] = -285.8\ \textstyle{kJ\over mol} \Delta H_f^0[\ce{H2O(l)}] = -285.8\ \textstyle{kJ\over mol}](local/cache-TeX/1ba37a1e30e17670c75bc644177e943f.png)
-
Entalpía de combustión del benceno sabiendo el calor a volumen constante (272)
Cuando se queman 12 g de benceno a volumen constante en un calorímetro adiabático, los 4 kg de agua que bañan al reactor aumentan su temperatura 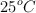 . Determina la entalpía de combustión del benceno en condiciones estándar.
. Determina la entalpía de combustión del benceno en condiciones estándar.
Datos: 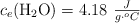
-
Entalpía de formación del metano (271)
Cuando reaccionan, en condiciones estándar, 6 g de carbono con hidrógeno gaseoso para formar metano se desprenden 37.452 kJ. Determina la entalpía de formación del metano.
-
Entalpía de reacción a partir de las entalpías de formación (270)
Calcula, en condiciones estándar, la entalpía de reacción para el proceso:

Datos (kJ/mol): 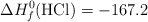 ;
; 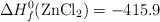
-
Entalpía de reacción a partir de las energía de enlace y las entalpías de formación (266)
Calcula la entalpía estándar de la reacción:
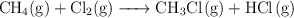
a partir de:
a) Las energías de enlace.
b) Las entalpías de formación.
Datos:
Energías de enlace (kJ/mol): C-H = 414 ; Cl-Cl = 244 ; C-Cl = 330 ; H-Cl = 430
Entalpías de Formación (kJ/mol): 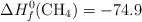 ;
; 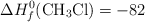 ;
; 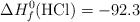
 Entalpía
Entalpía