Un pedazo de plomo de 250 g se calienta a ![]() y se echa en 500 g de agua inicialmente a
y se echa en 500 g de agua inicialmente a ![]() . Despreciando la capacidad calórica del recipiente, ¿cuál es la temperatura final del plomo y el agua?
. Despreciando la capacidad calórica del recipiente, ¿cuál es la temperatura final del plomo y el agua?
Datos: ![]() ;
; ![]()
Ejercicios y problemas sobre calor, temperatura, calorimetría, máquinas térmicas y dilatación.
Un pedazo de plomo de 250 g se calienta a ![]() y se echa en 500 g de agua inicialmente a
y se echa en 500 g de agua inicialmente a ![]() . Despreciando la capacidad calórica del recipiente, ¿cuál es la temperatura final del plomo y el agua?
. Despreciando la capacidad calórica del recipiente, ¿cuál es la temperatura final del plomo y el agua?
Datos: ![]() ;
; ![]()
Un recipiente de aluminio de 450 g de masa contiene 120 g de agua a temperatura de ![]() . Se deja caer dentro del recipiente un bloque de hierro de 220 g a la temperatura de
. Se deja caer dentro del recipiente un bloque de hierro de 220 g a la temperatura de ![]() . Calcula la temperatura final del sistema.
. Calcula la temperatura final del sistema.
Datos: 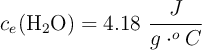 ;
; 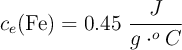 ;
; 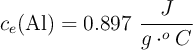
Una esfera de acero de 400 g a una temperatura de ![]() es sumergida en 3 L de agua a una temperatura de
es sumergida en 3 L de agua a una temperatura de ![]() . ¿Cuál es la temperatura final del sistema?
. ¿Cuál es la temperatura final del sistema?
Datos: 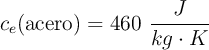 ;
; 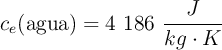
Se desea enfriar 2 kg de agua a ![]() con agua que esta a
con agua que esta a ![]() . Para que la mezcla tenga una temperatura de
. Para que la mezcla tenga una temperatura de ![]() , ¿qué cantidad de agua hay que añadir?
, ¿qué cantidad de agua hay que añadir?
Se calienta 1 kg de hielo a ![]() hasta que se funden 300 g de éste. Calcula la energía que se ha necesitado.
hasta que se funden 300 g de éste. Calcula la energía que se ha necesitado.