Un producto secundario de la reacción que infla los airbags es el sodio, que es muy reactivo y puede encenderse en el aire. El sodio que se produce durante el proceso de inflado reacciona con otro compuesto que se agrega al contenido de la bolsa, ![]() , según la reacción:
, según la reacción:
![]()
¿Cuántos gramos de ![]() se necesitan para eliminar 5 gramos de Na?
se necesitan para eliminar 5 gramos de Na?
De acuerdo con la ecuación química:
![]()
es correcto afirmar que:
a) 2 mol de ![]() producen 2 mol de
producen 2 mol de ![]() y dos mol de
y dos mol de ![]() .
.
b) 1 mol de ![]() produce 2 mol de
produce 2 mol de ![]() y mol de
y mol de ![]() .
.
c) 72 g de ![]() producen 135 g de
producen 135 g de ![]() y 1 mol de
y 1 mol de ![]() .
.
d) 135 g de ![]() reaccionan con una molécula de
reaccionan con una molécula de ![]() .
.
¿Cuántos gramos de nitrito de sodio se obtienen a partir de 120 g de nitrato de sodio? La reacción que se da es:
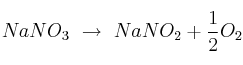
Datos: N = 14 ; O = 16 ; Na = 23
La reacción entre el ácido clorhídrico y el cinc, en medio acuoso, produce cloruro de cinc e hidrógeno gaseoso. Si tras la reacción se recogen 12.5 L de hidrógeno, medidos en condiciones normales, calcula:
a) La masa de cada reactivo que ha reaccionado.
b) Los moles de cloruro de cinc producidos.
Masas atómicas: Zn = 65.4 ; H = 1 ; Cl = 35.5
El peróxido de hidrógeno (líquido) se descompone en agua (líquido) y oxígeno (gas), liberando gran cantidad de energía:
a) ¿Cuál será la masa de agua que se obtiene cuando se descomponen 250 mL de peróxido de hidrógeno?
b) ¿Qué volumen de oxígeno se obtendrá, medido a 30 ºC y 1,2 atm?
c) ¿Cuántas moléculas de oxígeno habrá en el volumen calculado?
Datos: C = 12 ; H = 1 ; O = 16 ; ![]()
La velocidad media de una reacción puede ser calculada por la relación entre las variaciones de un reactivo o producto en el intervalo de tiempo en que esto ocurre. De esta forma, en la siguiente reacción, ![]() , si se producen de 6 moles de
, si se producen de 6 moles de ![]() en 50 minutos, ¿cuál será la velocidad de la reacción con respecto al propano?
en 50 minutos, ¿cuál será la velocidad de la reacción con respecto al propano?
Cuando el etano (![]() ) se quema con oxígeno se producen dióxido de carbono y agua. Si el proceso se da en condiciones normales, calcula:
) se quema con oxígeno se producen dióxido de carbono y agua. Si el proceso se da en condiciones normales, calcula:
a) El volumen de dióxido de carbono que se obtiene al quemar 80 g de etano.
b) La masa de agua que se produce.
Masas atómicas: C = 12 ; H = 1 ; O = 16.
El gas amoniaco se descompone dando gas nitrógeno y gas hidrógeno:
a) Escribe y ajusta la reacción.
b) En un recipiente se introducen 34 g de amoniaco a ![]() y 1 atm. ¿Qué volumen de nitrógeno e hidrógeno se obtendrá en esas mismas condiciones?
y 1 atm. ¿Qué volumen de nitrógeno e hidrógeno se obtendrá en esas mismas condiciones?
(Masas atómicas: N= 14 ; H = 1)
El nitrógeno reacciona con el oxígeno para formar el tetraóxido de dinitrógeno.
a) Escribe la ecuación química sabiendo que todas las sustancias son gaseosas.
b) Calcula el volumen de nitrógeno, medido en condiciones normales, que sería necesario para obtener 34 g de tetraóxido de dinitrógeno.
c) ¿Cuántas moléculas de oxígeno reaccionarán?
Datos: N = 14 ; O = 16 ; ![]() .
.
 Ejercicios FyQ
Ejercicios FyQ