-
PAU Andalucía: química (junio 2025) - pregunta 1 - cuestión 1B (8476)
a) Dadas las moléculas 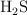 y
y 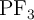 , razona en cuál o cuáles de ellas el átomo central presenta algún par de electrones sin compartir.
, razona en cuál o cuáles de ellas el átomo central presenta algún par de electrones sin compartir.
b) Justifica la geometría que presenta la molécula 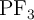 .
.
c) Indica la hibridación del átomo central del 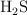 .
.
d) ¿Por qué la molécula 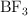 es apolar?
es apolar?
-
PAU Andalucía: química (junio 2025) - pregunta 1 - cuestión 1A (8475)
Escribe las configuraciones electrónicas de los siguientes elementos:
a) El elemento del grupo 14 de menor carácter metálico.
b) El elemento del tercer periodo de mayor radio atómico.
c) El elemento del cuarto periodo con solo un electrón en un orbital «d».
d) El elemento del segundo periodo que tiene más tendencia a formar un catión divalente.
-
Reacciones, potencial y constante de equilibrio de una pila galvánica (8468)
Se construye una pila galvánica utilizando un electrodo de níquel sumergido en una disolución de 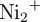 1.0 M y un electrodo de plata sumergido en una disolución de
1.0 M y un electrodo de plata sumergido en una disolución de 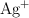 1.0 M, a una temperatura de 298 K.
1.0 M, a una temperatura de 298 K.
a) Escribe las semirreacciones y la reacción global de la pila, indicando cuál es el ánodo y el cátodo.
b) Calcula el potencial estándar de la pila (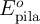 ).
).
c) Determina la constante de equilibrio de la reacción global.
d) Si la concentración de 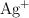 se reduce a 0.01 M, calcula el nuevo potencial de la pila (
se reduce a 0.01 M, calcula el nuevo potencial de la pila (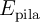 ).
).
Datos: 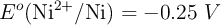 ;
; 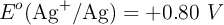 ;
; 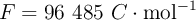 ;
; 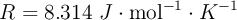
-
Campo magnético resultante de un sistema con dos conductores y una espira circular (8463)
El centro de una espira circular de radio 8 cm equidista 8 cm de 2 conductores rectilíneos por los cuales circulan corrientes de sentidos iguales y magnitud 30 A. Si la corriente que circula por la espira es de 10 A, calcula el campo magnético resultante en el centro de la espira y el sentido de la corriente de la espira.
Dato: 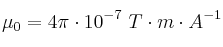
-
Concentraciones de los componentes de una mezcla de disoluciones (8460)
Se prepara una disolución mezclando 50.0 g de sulfato de cobre(II) pentahidratado (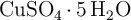 ) con 200 mL de una disolución acuosa de
) con 200 mL de una disolución acuosa de 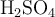 1.50 M, cuya densidad es 1.12 g/mL. Posteriormente, se diluye la mezcla hasta un volumen final de 500 mL, obteniendo una disolución con una densidad de 1.18 g/mL. Calcula:
1.50 M, cuya densidad es 1.12 g/mL. Posteriormente, se diluye la mezcla hasta un volumen final de 500 mL, obteniendo una disolución con una densidad de 1.18 g/mL. Calcula:
a) La molaridad de 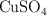 en la disolución final.
en la disolución final.
b) La molalidad de 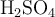 en la disolución final.
en la disolución final.
c) El porcentaje en masa de 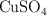 en la disolución final.
en la disolución final.
d) La fracción molar de agua en la disolución final.
Datos: Cu = 63.55, S = 32.07, O = 16.00, H = 1.01. Considera que el 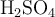 se disocia completamente en sus iones.
se disocia completamente en sus iones.
 RESUELTO
RESUELTO