-
Entalpía estándar de reacción de la combustión del propano (462)
Determina la entalpía estándar de la siguiente reacción:
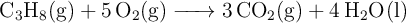
Datos expresados en 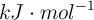
![\Delta H_f^0\ [\ce{C3H8(g)}] = -103.8 \Delta H_f^0\ [\ce{C3H8(g)}] = -103.8](local/cache-TeX/28e2192959798b51aad3ddc624be8ddb.png) ,
, ![\Delta H_f^0\ [\ce{CO2(g)}] = -393.5 \Delta H_f^0\ [\ce{CO2(g)}] = -393.5](local/cache-TeX/31b6847bffa4d7279233e7cd8453e3e2.png) y
y ![\Delta H_f^0\ [\ce{H2O(l)}] = -285.8 \Delta H_f^0\ [\ce{H2O(l)}] = -285.8](local/cache-TeX/92d3e50b72dfe725fde1059f51cfb17c.png)
-
Cálculo de la entalpía de reacción de la combustión del amoniaco (461)
Determina la entalpía estándar de la siguiente reacción:
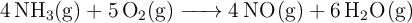
Datos en 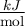 :
:
![\Delta H_f^0 [\ce{NH3(g)}] = -46.20 \Delta H_f^0 [\ce{NH3(g)}] = -46.20](local/cache-TeX/86bb5a7a6238d9e85a706b1e94569f85.png) ;
; ![\Delta H_f^0 [\ce{NO(g)}] = 90.37 \Delta H_f^0 [\ce{NO(g)}] = 90.37](local/cache-TeX/5ede56a3c0c1bf67f6a84d3e676230df.png) ;
; ![\Delta H_f^0 [\ce{H2O(g)}] = -241.80 \Delta H_f^0 [\ce{H2O(g)}] = -241.80](local/cache-TeX/7d6122970d76bcc899ef269b0470f6ce.png)
-
Energía que aporta una manzana de 140 g (460)
El contenido en glucosa de una manzana es un 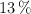 . Si la entalpía de combustión de la glucosa
. Si la entalpía de combustión de la glucosa 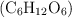 , es
, es 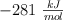 , calcula las calorías que aporta al cuerpo humano la ingesta de una manzana de 140 g. Ten en cuenta que una caloría dietética equivale a una kcal).
, calcula las calorías que aporta al cuerpo humano la ingesta de una manzana de 140 g. Ten en cuenta que una caloría dietética equivale a una kcal).
-
Energía de enlace del hidrógeno en la reacción de formación del amoniaco (459)
Sabiendo que 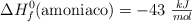 y las energías de enlace
y las energías de enlace 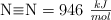 y
y 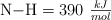 , determina la energía de enlace
, determina la energía de enlace 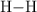 .
.
-
Entalpía de reacción a partir de las energías de enlace (458)
Calcula la variación de entalpía para la siguiente reacción:
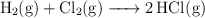
Sabiendo que las energías de enlace son: 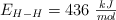 ,
, 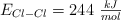 y
y 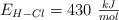 .
.
 RESUELTO
RESUELTO