-
Concentración en el equilibrio de un producto conocida la constante de equilibrio (243)
En un recipiente de 2 L, a 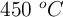 , se produce el equilibrio:
, se produce el equilibrio:
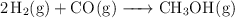
cuya  tiene un valor de 300. En el equilibrio hay 0.1 mol de
tiene un valor de 300. En el equilibrio hay 0.1 mol de 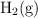 y 0.05 mol de
y 0.05 mol de 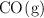 . Calcula la concentración de
. Calcula la concentración de 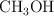 en el equilibrio, expresada en mol/L.
en el equilibrio, expresada en mol/L.
-
Peso molecular de un gas sabiendo su densidad (242)
La densidad de un gas que se comporta como ideal es 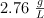 a 2 atm y
a 2 atm y  . ¿Cuál es su peso molecular?
. ¿Cuál es su peso molecular?
-
Aplicación de la ley de conservación de masa para calcular la masa de producto (241)
Determina los gramos de óxido de cobre que se obtienen cuando 6.35 g de cobre reaccionan con 2.00 g de oxígeno, sobrando 0.40 g de este gas. Razona tu respuesta.
-
Ejercicio de nomenclatura de compuestos orgánicos e inorgánicos (240)
Formula o nombra, según corresponda, las siguientes especies químicas: a) 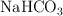 ; b)
; b) 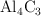 ; c)
; c) 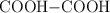 ; d)
; d) 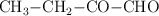 ; e)
; e) 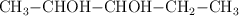 ; f) sulfuro de bario ; g) etanonitrilo ; h) metilamina.
; f) sulfuro de bario ; g) etanonitrilo ; h) metilamina.
-
Fórmula empírica de un compuesto a partir de su composición porcentual (237)
Determinar la fórmula empírica de una sustancia contiene el 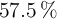 de Na, el
de Na, el 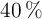 de O y el resto de hidrógeno.
de O y el resto de hidrógeno.
(Datos: Na = 23 ; O = 16 ; H = 1)
 RESUELTO
RESUELTO