Los números de oxidación representan la carga aparente que tiene un átomo cuando se combina con otros para formar una molécula. No procede ahora ahondar en el porqué de esta definición sino que basta con aprenderse éstos para los átomos más comunes. En la siguiente tabla están recogidos los estados de oxidación de los elementos del sistema periódico. Si los miras detenidamente verás que en algunos casos se pueden obtener reglas que te ayuden a memorizarlos:

-
Los metales tienen números de oxidación positivos. Los no metales los pueden tener tanto positivos como negativos.
-
Observa que los metales de los grupos 1, 2 y 3 tienen estados de oxidación que coinciden con el número del grupo.
-
Los metales de los grupos 4, 5, 6 y 7 tienen varios números de oxidación pero, como mínimo, presentan el número de oxidación del grupo.
-
Desde el grupo 14 al 17 podemos saber el número de oxidación negativo que presentan sus elementos si restamos 18 al número de su grupo. Por ejemplo, para el grupo 15 sería 15 - 18 = (3-).
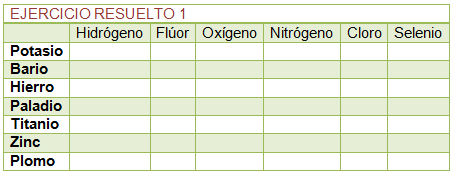
CÁLCULO DEL NÚMERO DE OXIDACIÓN.
Para conocer el número de oxidación de un átomo, ya sea aislado o formando parte de un molécula, podemos emplear las siguientes reglas:
- El número de oxidación de los elementos en su estado natural es siempre 0, ya sean átomos aislados (Ni, K), moléculas diatómicas (Br2, I2) o poliatómicas (P4, S8).
- El número de oxidación del oxígeno es 2-, excepto en los peróxidos (O2)2- que es 1- y 2+ en su combinación con el flúor.También encontramos los superóxidos o hiperóxidos (O2)-, en los que el número de oxidación es ½ -.
- El número de oxidación del hidrógeno es 1+ cuando está unido con átomos no metálicos y 1- cuando lo está a átomos metálicos.
- El número de oxidación del flúor es siempre 1-.
- Cuando los elementos de los grupos 15, 16 y 17 forman combinaciones binarias, usan el número de oxidación más bajo. Los elementos de los grupos 1, 2 y 3 siempre tienen estado de oxidación 1+, 2+ y 3+ respectivamente.
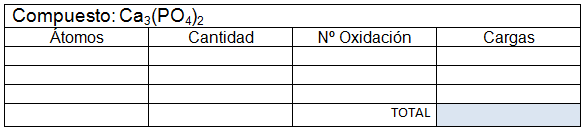
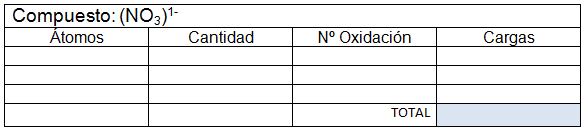
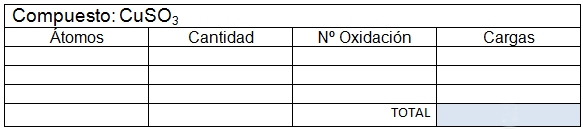
- En un compuesto neutro, la suma de todos los números de oxidación debe ser cero. En un ion poliatómico, la suma de los números de oxidación debe ser igual a la carga neta del ion.