Para formular este tipo de compuestos basta con escribir a la izquierda el elemento menos electronegativo y a la derecha el más electronegativo, teniendo en cuenta que la suma de los estados de oxidación ha de ser cero, si se trata de una molécula, o igual a la carga de la combinación, si se trata de un ión. Te lo explico en este vídeo paso a paso:
2.2. Compuestos binarios
Nomenclatura de composición.
La forma de nombrar será leyendo la fórmula de derecha a izquierda. Recuerda que hay tres modos de nomenclatura de composición: la que usa los prefijos numerales, la que usa el número de carga y la que usa el número de oxidación.
Prefijos numerales.
Empezaremos nombrando el elemento de la derecha y usaremos el sufijo -uro (la excepción es el oxígeno que se nombra como óxido), después debe aparecer la preposición "de" y por último el nombre del elemento de la izquierda. Cuando el subíndice es uno podemos omitir el prefijo mono.
Número de carga.
Esta forma de nombrar es válida para los compuestos iónicos y debemos estar seguros de que el compuesto tiene esa naturaleza y, por lo tanto, no es muy aconsejable. Seguimos la misma secuencia de antes pero después del nombre de cada elemento ponemos, entre paréntesis, la carga del ión. Recuerda que la carga de los aniones se puede omitir si no hay lugar a confusión pero no se puede hacer lo mismo con la carga del catión.
Número de oxidación.
Esta forma de nombrar se puede aplicar a cualquier combinación binaria y no tiene el problema que hemos visto con el número de carga. Lo que haremos es colocar al final del nombre, entre paréntesis y con números romanos, el número de oxidación del elemento escrito a la izquierda. Cuando no exista ambigüedad, debemos omitir el número de oxidación.
Fíjate en la siguiente tabla en la que se nombran las distintas moléculas de los tres modos, cuando es posible:
| Fórmula | Prefijos numerales | Número de carga | Número de oxidación |
| CaI2 | diyoduro de calcio | yoduro de calcio(2+) | yoduro de calcio |
| PCl5 | pentacloruro de fósforo | cloruro de fósforo(V) | |
| PdS | sulfuro de paladio | sulfuro(2-) de paladio(2+) | sulfuro de paladio(II) |
| Na2O | óxido de disodio | óxido de sodio(1+) | óxido de sodio |
Compuestos binarios (I)
Copia la tabla en tu libreta y complétala:
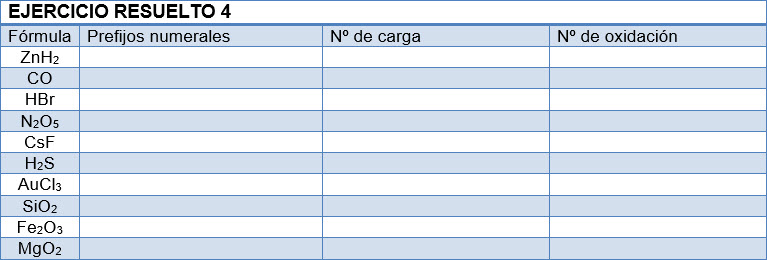
(O2+F2-) → OF2 : Difluoruro de oxígeno o fluoruro de oxígeno(II)
(O2-Cl2+) → OCl2 : Dicloruro de oxígeno o cloruro de oxígeno(-II)
Nomenclatura de adición.
Esta forma de nombrar se parece mucho a la de composición pero, recuerda, no se emplean los números de oxidación. En las combinaciones binarias no se diferencia de la nomenclatura de composición que hemos visto, ya que sería como usar sólo los prefijos numerales, así que no abundaremos más en este tipo de nomenclatura en este apartado.
Nomenclatura de sustitución.
En algunos compuestos binarios sí que existen diferencias importantes entre esta forma de nombrar y la nomenclatura de composición. En el epígrafe 1.2 vimos cómo era la nomenclatura de sustitución y en la siguiente tabla se ilustran algunos ejemplos más:
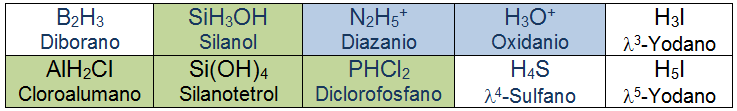
Los compuestos marcados en verde no son binarios pero sirven como ejemplo para entender cómo se usa la nomenclatura de sustitución. Los que están marcados en azul son iones (cationes) y también se pueden nombrar como derivados de los hidruros progenitores.
IMPORTANTE
Observa cómo se formulan algunos peróxidos del grupo 1 y grupo 2:
Grupo 1: Li2O2 ; Na2O2 ; K2O2
Grupo 2: CaO2 ; SrO2 ; BaO2
Para nombrarlos podemos hacerlo como peróxidos (peróxido de sodio / peróxido de bario) o usando los prefijos numerales (dióxido de disodio / dióxido de bario).
Con los elementos de los grupos 16 (S, Se y Te) y 17 (F, Cl, Br y I), y de acuerdo con el convenio de la IUPAC, el hidrógeno presenta número de oxidación 1+. Los compuestos que se forman son gases y debes seguir la norma general para formularlos. Para nombrarlos debes usar la nomenclatura sistemática.
Los compuestos del párrafo anterior, en disolución acuosa, se comportan como ácidos y se han nombrado tradicionalmente con la palabra ácido seguida del nombre del elemento con la terminación -hídrico.
| Fórmula | Nombre |
| H2S | ácido sulfhídrico |
| H2Se | ácido selenhídrico |
| H2Te | ácido telurhídrico |
| HF | ácido fluorhídrico |
| HCl | ácido clorhídrico |
| HBr | ácido bromhídrico |
| HI | ácido yodhídrico |
Compuestos binarios (II)
Copia la tabla en tu libreta y complétala:
| Fórmula | Nombre sistemático | En disolución acuosa |
| seleniuro de hidrógeno | ||
| HCl | ||
| sulfuro de hidrógeno | ||
| ácido fluorhídrico |
Ejercicio de evaluación
A continuación se muestra el enlace a un ejercicio que debes realizar. Descárgalo y rellena las tablas que encontrarás. Luego envía el ejercicio a tu profesor o profesora para que lo corrija. Recuerda que debes ser muy cuidadoso con la ortografía y con las normas que has estudiado para escribir nombres y fórmulas.
Obra publicada con Licencia Creative Commons Reconocimiento 4.0