Oxoácidos.
Son compuestos ternarios que tienen en su composición átomos de hidrógeno y oxígeno. El otro átomo puede ser un átomo no metálico e incluso de metales como el cromo o el manganeso. Se pueden nombrar según la nomenclatura de adición, la nomenclatura de hidrógeno o usando los nombres tradicionales (ya que la IUPAC lo permite). Quizás el modo más sistemático y más fácil para nombrar los oxoácidos sea la nomenclatura de hidrógeno pero es necesario conocer las otras formas de nombrar porque podemos encontrarlas en la bibliografía química.
a) Nomenclatura de adición.
Es la nomenclatura sistemática para este tipo de compuestos. Debemos considerar que hay un átomo central (que es el átomo que no es ni hidrógeno ni oxígeno) que está unido a los demás átomos (ligandos). Se comienza nombrando a los ligandos por orden alfabético e indicando la cantidad en la que están por medio de los prefijos numerales. El átomo central es el último que se nombra sin terminación alguna. La tilde solo se pone en el nombre del átomo central. Veamos algunos ejemplos:
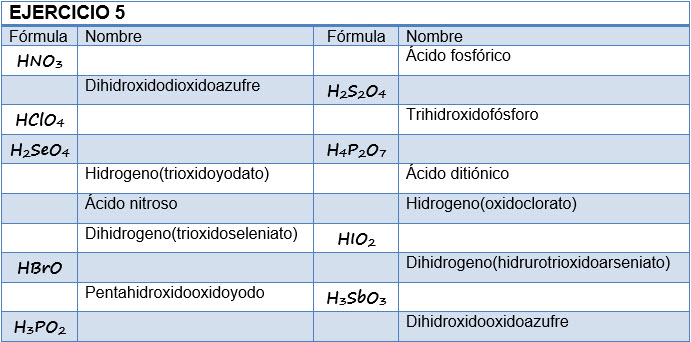
- H2CO3: Consideramos que el carbono está rodeado de dos grupos (OH) y un átomo de oxígeno. Lo podemos escribir como CO(OH)2. Ahora empezamos a nombrar los ligandos y terminamos por el átomo central: dihidroxidooxidocarbono.
- H2SO4: Hacemos igual que antes y reescribimos el compuesto como SO2(OH)2. El nombre nos quedará como dihidroxidodioxidoazufre.
- HNO3: El nitrógeno es el átomo central y está unido a un grupo (OH) y dos oxígenos, NO2OH. Lo nombramos como hidroxidodioxidonitrógeno.
En el caso de que en lugar de una molécula neutra tuviésemos un anión, es decir, un ácido que ha perdido algún o todos sus átomos de hidrógeno, la forma de nombrarlo sería análoga pero usando el sufijo -ato al final del nombre del átomo central e indicado entre paréntesis la carga del anión:
- HSO3-: Hidroxidodioxidosulfato(1-).
- NO2-: Dioxidonitrato(1-).
- HBO32-: Hidroxidodioxidoborato(2-).
b) Nomenclatura de hidrógeno.
Cuando escribimos los oxoácidos lo hacemos agrupando los átomos de hidrógeno y colocándolos al principio de la fórmula; H2SO4, HMnO4, HClO3... Para nombrar los oxoácidos así escritos podemos usar la nomenclatura de hidrógeno que consiste en poner en primer lugar la palabra hidrogeno (sin tilde), seguida del anión que deriva de la nomenclatura de adición escrito entre paréntesis. Vemos algunos ejemplos:
- HClO3: hidrogeno(trioxidoclorato).
- HMnO4: hidrogeno(tetraoxidomanganato).
- H2SeO4: dihidrogeno(tetraoxidoseleniato).
- HCO3-: hidrogeno(trioxidocarbonato)(1-).
- HPO42-: hidrogeno(tetraoxidofosfato)(2-).
c) Nomenclatura tradicional.
Los nombres tradicionales de los oxoácidos siguen unas reglas que han quedado obsoletas. La mejor manera de enfrentar este tipo de nomenclatura es usar la memoria. Apréndete los nombres de los oxoácidos, así como sus aniones correspondientes, y podrás formular como un «profesional».
A continuación tienes unas tablas de oxoácidos y oxoaniones comunes que te pueden ser de ayuda:
OXOÁCIDOS COMUNES ACEPTADOS
|
| Grupo 13 |
Grupo 14 |
Grupo 15 |
Grupo 16 |
Grupo 17 |
Otros |
| H3BO3 |
ácido bórico |
H2CO3 |
ácido carbónico |
HONC |
ácido fulmínico |
H2SO4 |
ácido sulfúrico |
HClO |
ácido hipocloroso |
H2CrO4 |
ácido crómico |
|
|
HOCN |
ácido ciánico |
HNO3 |
ácido nítrico |
H2SO3 |
ácido sulfuroso |
HClO2 |
ácido cloroso |
H2Cr2O7 |
ácido dicrómico |
|
|
H4SiO4 |
ácido silícico |
HNO2 |
ácido nitroso |
H2S2O7 |
ácido disulfúrico |
HClO3 |
ácido clórico |
H2MnO4 |
ácido mangánico |
|
|
|
|
H3PO4 |
ácido fosfórico |
H2S2O5 |
ácido disulfuroso |
HClO4 |
ácido perclórico |
HMnO4 |
ácido permangánico |
|
|
|
|
H3PO3 |
ácido fosforoso |
H2S2O6 |
ácido ditiónico |
HBrO |
ácido hipobromoso |
|
|
|
|
|
|
H3PO2 |
ácido fosfínico |
H2S2O4 |
ácido ditionoso |
HBrO2 |
ácido bromoso |
|
|
|
|
|
|
H3AsO4 |
ácido arsénico |
H2SeO4 |
ácido selénico |
HBrO3 |
ácido brómico |
|
|
|
|
|
|
H3AsO3 |
ácido arsenoso |
H2SeO3 |
ácido selenoso |
HBrO4 |
ácido perbrómico |
|
|
|
|
|
|
H3AsO2 |
ácido arsínico |
H2TeO4 |
ácido telúrico |
HIO |
ácido hipoyodoso |
|
|
|
|
|
|
|
|
H6TeO6 |
ácido ortotelúrico |
HIO2 |
ácido yodoso |
|
|
|
|
|
|
|
|
|
|
HIO3 |
ácido yódico |
|
|
|
|
|
|
|
|
|
|
HIO4 |
ácido peryódico |
|
|
OXOANIONES COMUNES ACEPTADOS
|
| Grupo 13 |
Grupo 14 |
Grupo 15 |
Grupo 16 |
Grupo 17 |
Otros |
| (H2BO3)- |
dihidrogeno-borato |
(HCO3)- |
hidrogeno-carbonato |
NO3- |
nitrato |
HSO4- |
hidrogeno-sulfato |
ClO- |
hipoclorito |
CrO42- |
cromato |
| (HBO3)2- |
hidrogeno-borato |
CO32- |
carbonato |
NO2- |
nitrito |
SO42- |
sulfato |
ClO2- |
clorito |
Cr2O72- |
dicromato |
| BO33- |
borato |
SiO42- |
silicato |
(H2PO4)- |
dihidrogeno-fosfato |
SO32- |
sulfito |
ClO3- |
clorato |
MnO42- |
manganato |
|
|
|
|
(HPO4)2- |
hidrogeno-fosfato |
S2O72- |
disulfato |
ClO4- |
perclorato |
MnO4- |
permanganato |
|
|
|
|
PO43- |
fosfato |
S2O52- |
disulfito |
BrO- |
hipobromito |
|
|
|
|
|
|
PO33- |
fosfito |
S2O62- |
ditionato |
BrO2- |
bromito |
|
|
|
|
|
|
AsO43- |
arsenato |
S2O42- |
ditionito |
BrO3- |
bromato |
|
|
|
|
|
|
AsO33- |
arsenito |
SeO42- |
selenato |
BrO4- |
perbromato |
|
|
|
|
|
|
|
|
SeO32- |
selenito |
IO- |
hipoyodito |
|
|
|
|
|
|
|
|
TeO42- |
telurato |
IO2- |
yodito |
|
|
|
|
|
|
|
|
Te2O62- |
ortotelurato
|
IO3- |
yodato |
|
|
|
|
|
|
|
|
|
|
IO4- |
peryodato |
|
|
Aunque los nombres estén presentados con un guion, se escriben sin él. Lo he tenido que poner para evitar problemas de formato en la tabla