-
Concentraciones en equilibrio, Kc y Kp en la reacción de formación del amoniaco (6221)
En un recipiente de 10 L se introducen 1 mol de nitrógeno y 2 mol de hidrógeno, ambos en estado gaseoso, que se calientan hasta 618 K. Una vez que se alcanza el equilibrio, se obtiene una mezcla que ejerce una presión total de 9.48 atm según la reacción:
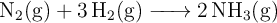
Calcula:
a) Las concentraciones de 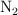 ,
, 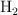 y
y 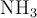 en el equilibrio.
en el equilibrio.
b) La  .
.
c) La  .
.
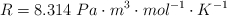
-
Calcula la constante de equilibrio de una neutralización
Calcula la constante de equilibrio que se obtiene en una neutralización al mezclar 20 mililitros de una solución de 0.3 molar de hidróxido de calcio con 10 mililitros de solución 0.25 molar de ácido fosfórico. Supón que los volúmenes son aditivos.
-
Constante de equilibrio a partir de las concentraciones iniciales
Se colocan en un recipiente de 2 litros, 4 moles de  y 3 moles de
y 3 moles de  . Si al alcanzar el equilibrio se encuentran 2 moles de
. Si al alcanzar el equilibrio se encuentran 2 moles de 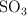 , calcula la constante de equilibrio para la reacción.
, calcula la constante de equilibrio para la reacción.
-
EBAU Andalucía: química (junio 2018) - ejercicio A.5 (4656)
En un reactor de 5 L se introducen inicialmente 0.8 moles de 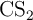 y 0.8 moles de
y 0.8 moles de 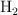 . A
. A 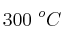 se establece el equilibrio:
se establece el equilibrio:
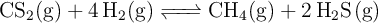
siendo la concentración de 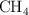 de 0.025 mol/L. Calcula:
de 0.025 mol/L. Calcula:
a) La concentración molar de todas las especies en el equilibrio.
b)  y
y  a dicha temperatura.
a dicha temperatura.
-
Equilibrio químico Opción A EBAU Andalucía junio 2017
Para el equilibrio: 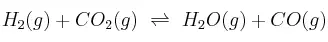 , la constante
, la constante  es 4,40 a 200 K. Calcula:
es 4,40 a 200 K. Calcula:
a) Las concentraciones en el equilibrio cuando se introducen simultáneamente 1 mol de 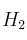 y 1 mol de
y 1 mol de  en un reactor de 4,68 L a dicha temperatura.
en un reactor de 4,68 L a dicha temperatura.
b) La presión parcial de cada especie en el equilibrio y el valor de  .
.
Dato: 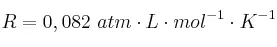
 Concentraciones
Concentraciones