-
Composición centesimal a partir de la ley de Proust
Hallar el porcentaje de cada elemento en los siguientes compuestos, a partir de la Ley de Proust:
a) 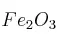 , b)
, b) 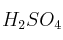 , c)
, c) 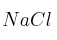 y d)
y d) 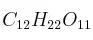
Masas atómicas: Fe = 56 ; O = 16 ; S = 32 ; Na = 23 ; Cl = 35,5 ; H = 1.
-
Aplicación de las leyes de Lavoisier y de Proust (5081)
Si 24 g de magnesio se combinan exactamente con 16 g de oxígeno atómico para formar óxido de magnesio:
a) ¿Cuántos gramos de óxido se habrán formado?
b) A partir de 6 g de magnesio, ¿cuántos gramos de oxígeno atómico se combinarán?
Especifica qué ley ponderal aplicas en cada caso.
-
Aplicación de la ley de Proust (5001)
52 gramos de cromo (Cr) reaccionan completamente con 48 gramos de oxígeno (O) para formar un óxido de cromo. Si se hacen reaccionar 28 gramos de cromo con 24 gramos de oxígeno:
a) ¿Sobrará alguno de los reactivos?
b) ¿En qué cantidad?
c) ¿Cuánto óxido de cromo se formará?
-
Ley de las proporciones definidas: cantidades de oxígeno con carbono (4819)
Se consumen exactamente 10.67 g de oxígeno al reaccionar con 4.00 g de carbón finamente molido para obtenerse un óxido de carbono. Calcula las cantidades necesarias de oxígeno que reaccionarían con 3.00 g y con 9.50 g de carbón.
-
Composición centesimal del óxido de magnesio (4756)
Una alumna quiere saber la composición definida del óxido de magnesio. Para ello quema un trozo de magnesio de masa conocida obteniendo los siguientes datos:
Antes de la reacción. Masa de magnesio: 0.62 g.
Después de la reacción. Masa de óxido obtenida: 1.02 g.
¿Puedes ayudarla a establecer la relación entre las masas de las sustancias que reaccionan?
 Ley de Proust
Ley de Proust