-
Masa de magnesio impuro necesaria para obtener un volumen de hidrógeno
Una masa de magnesio reacciona con cantidad suficiente de ácido clorhídrico. ¿Cuántos gramos de magnesio, con una pureza del  , se necesitan para obtener 25 L de hidrógeno medidos a 667 mm Hg y
, se necesitan para obtener 25 L de hidrógeno medidos a 667 mm Hg y 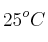 ?
?
Masa atómica del Mg = 24,3 ; 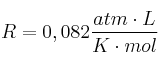
-
Aplicación de reactivo limitante, pureza de reactivos y rendimiento de reacción (5176)
Se dispone de 87 g de nitrato de plata, con el 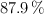 de pureza, que reacciona con 50 mL de una disolución de ácido clorhídrico, al
de pureza, que reacciona con 50 mL de una disolución de ácido clorhídrico, al 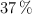 en masa y densidad 1.07 g/mL, obteniéndose cloruro de plata y ácido nítrico, siendo el rendimiento de la reacción del
en masa y densidad 1.07 g/mL, obteniéndose cloruro de plata y ácido nítrico, siendo el rendimiento de la reacción del 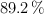 .
.
a) Escribe la reacción química y ajústala si fuera necesario.
b) Calcula la cantidad de cloruro de plata y de ácido nítrico que se obtiene en la reacción.
c) Determina la cantidad del reactivo en exceso que no reacciona.
Masas atómicas: H = 1 ; O = 16 ; N = 14 ; Cl = 35.5 ; Ag = 108.
-
Masa de hidrógeno que se produce a partir de un cinc impuro (5062)
Se hacen reaccionar 22.75 g de cinc, que contienen un 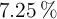 de impurezas, con ácido clorhídrico suficiente. Calcula la masa de dihidrógeno desprendida.
de impurezas, con ácido clorhídrico suficiente. Calcula la masa de dihidrógeno desprendida.
Masas atómicas: Zn = 63.38 u ; H = 1 u.
-
Estequiometría: relación entre masas de reactivos y productos 0002
El fosfato de calcio es un sólido que se encuentra en un mineral llamado apatita y en fosfato de roca. Es el principal constituyente de los huesos de los animales y se emplea en la fabricación de fertilizantes.
Si se quieren obtener 285,8 g de fosfato de calcio 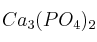 del
del  de pureza, ¿cuántos gramos de ácido fosfórico del
de pureza, ¿cuántos gramos de ácido fosfórico del 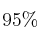 de pureza (
de pureza (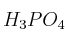 ) deben reaccionar con un exceso de hidróxido de calcio?
) deben reaccionar con un exceso de hidróxido de calcio?
-
Determinar la pureza de un reactivo (3051)
Una de las reacciones que se lleva a cabo en un alto horno donde el mineral de hierro se convierte en hierro fundido es:

Supón que se obtienen 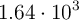 kg de Fe a partir de una muestra de
kg de Fe a partir de una muestra de 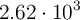 kg de
kg de 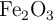 . Suponiendo que la reacción llegue a completarse, ¿cuál es la pureza, en tanto por ciento en masa, del
. Suponiendo que la reacción llegue a completarse, ¿cuál es la pureza, en tanto por ciento en masa, del 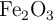 en la muestra original?
en la muestra original?
 Pureza
Pureza