-
Reacción redox entre una aleación de cobre y ácido nítrico (6127)
Cuando se hacen reaccionar 200 g de una aleación, que contiene cobre en un 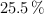 , con 180 mL de una disolución de ácido nítrico al
, con 180 mL de una disolución de ácido nítrico al 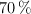 en masa y densidad 1.41 g/mL, se obtienen como productos de reacción óxido de nitrógeno(II), nitrato de cobre(II) y agua con un rendimiento del
en masa y densidad 1.41 g/mL, se obtienen como productos de reacción óxido de nitrógeno(II), nitrato de cobre(II) y agua con un rendimiento del 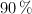 .
.
a) Ajusta la reacción que tiene lugar empleando el método del ion-electrón, indica cuál es el agente oxidante y el agente reductor, así como los estados de oxidación de las especies oxidadas y reducidas.
b) Calcula los gramos de nitrato de cobre(II) que se obtienen.
c) Si el óxido de nitrógeno(II) se recoge sobre agua a 293 K y 1 atm, calcula el volumen recogido.
Masas atómicas: Cu = 63.5 ; N = 14 ; O = 16 ; H = 1.
-
Reciclaje de latas para obtener estaño y producir óxido de estaño(IV)
A partir del reciclado de latas de conserva se puede obtener Sn y una empresa utiliza esta materia prima para la obtención de 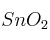 , que es un material base para la elaboración de sensores de gas. La reacción del proceso es la siguiente:
, que es un material base para la elaboración de sensores de gas. La reacción del proceso es la siguiente:
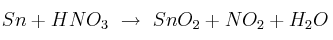
Teniendo en cuenta que cada lata pesa 16 g, de los cuales el 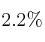 en peso es Sn, responde:
en peso es Sn, responde:
a) Si el rendimiento de la reacción es del 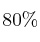 , ¿cuántas latas de conserva son necesarias para producir 70 g de
, ¿cuántas latas de conserva son necesarias para producir 70 g de 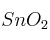 ?
?
b) ¿Cuál es la masa mínima de 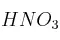 necesaria para que reaccione toda la cantidad de Sn requerida en este proceso?
necesaria para que reaccione toda la cantidad de Sn requerida en este proceso?
c) El 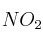 es un subproducto de la reacción, ¿qué volumen debería tener dicho recipiente para que, a
es un subproducto de la reacción, ¿qué volumen debería tener dicho recipiente para que, a 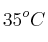 , soporte una presión de 1.5 atm?
, soporte una presión de 1.5 atm?
Masas atómicas: Sn = 118.7 ; N = 14 ; O = 16 ; H = 1.
-
Ampliación: masa de amoniaco para obtener una tonelada de ácido nítrico (método de Ostwald) (5985)
El ácido nítrico se produce industrialmente mediante el proceso de Ostwald, que se representa por medio de las siguientes ecuaciones químicas:

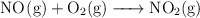
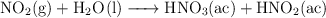
¿Qué masa de 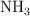 , en gramos, se debe utilizar para producir una tonelada de
, en gramos, se debe utilizar para producir una tonelada de 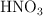 con el procedimiento descrito, suponiendo un rendimiento del
con el procedimiento descrito, suponiendo un rendimiento del 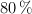 en cada uno de los pasos?
en cada uno de los pasos?
-
Rendimiento de reacción y masa de producto que se obtiene
Dada la reacción:
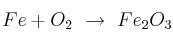
a) ¿Cuál es la masa de 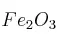 que se obtendría, con un rendimiento teórico del
que se obtendría, con un rendimiento teórico del 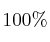 , a partir de 4,86 g de Fe con
, a partir de 4,86 g de Fe con 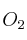 en exceso?
en exceso?
b) Si la masa que se obtiene en realidad es 6,76 g de 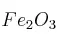 a partir de los 4,86 g de Fe, ¿cuál es el rendimiento porcentual de la reacción?
a partir de los 4,86 g de Fe, ¿cuál es el rendimiento porcentual de la reacción?
c) Bajo otras condiciones, el rendimiento porcentual del proceso es 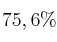 . ¿Cuántos gramos de
. ¿Cuántos gramos de 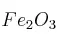 se obtienen con 4,86 g Fe en esas condiciones?
se obtienen con 4,86 g Fe en esas condiciones?
Masas atómicas: Fe = 56 ; O = 16.
-
Masas mínimas de reactivos para obtener una masa de producto cuando el rendimiento es menor del 100%
Dada la siguiente ecuación química:
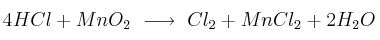
Calcula el volumen mínimo de solución de HCl al  (m/V) y la cantidad mínima de
(m/V) y la cantidad mínima de 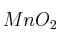 que se deberá poner en contacto si se desean producir 63 g de cloruro de manganeso, siendo el rendimiento de la reacción el
que se deberá poner en contacto si se desean producir 63 g de cloruro de manganeso, siendo el rendimiento de la reacción el 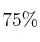 .
.
Datos: Mn = 55 ; Cl = 35,5 ; H = 1 ; O = 16.
 Rendimiento
Rendimiento