-
Presiones parciales de los reactivos de dos reacciones paralelas en el equilibrio (7827)
A temperaturas elevadas, el carbono y el dióxido de carbono reaccionan según la ecuación química en equilibrio:
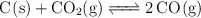
El carbonato de calcio también se descompone, a temperaturas elevadas, de acuerdo con la ecuación química:
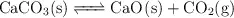
A 1 000 K, 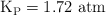 para la primera reacción, mientras que para la segunda reacción
para la primera reacción, mientras que para la segunda reacción 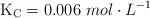 .
.
En un recipiente se introducen cantidades suficientes de carbono y de carbonato de calcio, ambos sólidos, se cierra herméticamente y se calientan hasta 1 000 K. Calcula, una vez establecido el equilibrio, las presiones parciales de cada uno de los gases presentes en el recipiente, la presión total a la que está sometido este y las concentraciones de todas las especies gaseosas.
Dato: El volumen ocupado por la mezcla de gases en equilibrio es de 10 litros.
-
EBAU Madrid: química (junio 2022) pregunta B.3 (7653)
El compuesto 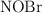 se descompone según la reacción:
se descompone según la reacción:
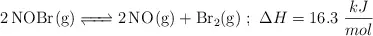
En un matraz de 1.0 L se introducen 2.0 mol de 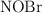 . Cuando se alcanza el equilibrio, a
. Cuando se alcanza el equilibrio, a  , se observa que se han formado 0.050 mol de
, se observa que se han formado 0.050 mol de 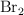 . Calcula:
. Calcula:
a) Las concentraciones de cada especie en el equilibrio.
b)  y
y  .
.
c) La presión total.
d) Justifica dos formas de favorecer la descomposición del 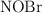 .
.
Dato: 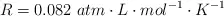
-
EBAU Andalucía: química (junio 2021) pregunta C.1 (7239)
Para la reacción de disociación del 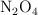 gaseoso,
gaseoso,  , la constante de equilibrio
, la constante de equilibrio  vale 2.49 a
vale 2.49 a 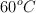 .
.
a) Sabiendo que la presión total en el equilibrio es de 1 atm, calcula el grado de disociación del 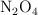 a esa temperatura y las presiones parciales de las especies en el equilibrio.
a esa temperatura y las presiones parciales de las especies en el equilibrio.
b) Determina el valor de  .
.
Dato: 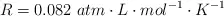
-
EBAU Andalucía: química (junio 2021) pregunta B.2 (7253)
Dada la reacción a  y 1 atm de presión
y 1 atm de presión 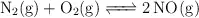 ;
; 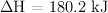 , razona si son verdaderas o falsas las siguientes afirmaciones:
, razona si son verdaderas o falsas las siguientes afirmaciones:
a) La constante de equilibrio  se duplica si se duplica la presión.
se duplica si se duplica la presión.
b) El sentido de la reacción se favorece hacia la izquierda si se aumenta la temperatura.
c) El valor de la constante de equilibrio para este proceso depende del catalizador utilizado.
-
Fracción molar del etino y Principio de Le Chatelier en la reacción del metano(7122)
Para la reacción:
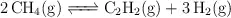
a 2 000 K, la constante de equilibrio 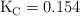 . Si en un volumen de 1.00 L de una mezcla en equilibrio a 2 000 K hay 0.10 moles de
. Si en un volumen de 1.00 L de una mezcla en equilibrio a 2 000 K hay 0.10 moles de 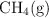 y 0.10 moles de
y 0.10 moles de 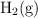 :
:
a) ¿Cuál es la fracción molar de 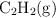 ?
?
b) ¿Cuándo está favorecida la conversión de 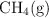 a
a 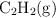 , a altas o a bajas presiones?
, a altas o a bajas presiones?
c) Si la mezcla en equilibrio a 2 000 K se traslada del matraz de 1.00 L a otro de 2.00 L, ¿aumentará, disminuirá o permanecerá constante el número de moles de 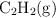 ?
?
 Constante equilibrio
Constante equilibrio