-
Volumen total de gases tras una combustión de etano y butano
Se tiene inicialmente una mezcla gaseosa formada por 0.50 L de etano, 2.5 L de butano y 20 L de oxígeno. Una vez los gases han reaccionado, calcula el volumen final, si todos los gases están medidos a iguales condiciones de presión y temperatura.
Nota: Considera el agua obtenida queda en estado gaseoso.
-
Reactivo limitante y masa de producto en la formación del KNO3 como fertilizante
El nitrato de potasio (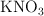 ) , muy usado como fertilizante, se obtiene a partir de la reacción entre el cloruro de potasio (
) , muy usado como fertilizante, se obtiene a partir de la reacción entre el cloruro de potasio (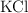 ) y el nitrato de sodio (
) y el nitrato de sodio (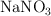 ) , obteniéndose además cloruro de sodio (
) , obteniéndose además cloruro de sodio (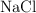 ). Si a 100 kg de
). Si a 100 kg de 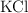 del
del 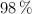 de riqueza se le agregan 400 L de disolución de
de riqueza se le agregan 400 L de disolución de 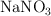 del
del 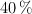 en masa y densidad
en masa y densidad 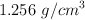 :
:
a) ¿Cuál es el reactivo limitante?
b) ¿Cuánto sobra del reactivo que está en exceso?
c) ¿Qué masa de 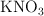 se ha obtenido si el rendimiento de la reacción es del
se ha obtenido si el rendimiento de la reacción es del 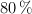 ?
?
Masas atómicas: K = 39 ; O = 16 ; N = 14 ; Cl = 35.5 ; Na =23.
-
Reactivo limitante y en exceso en la neutralización de HCl y NaOH (6520)
Se añaden 20 mL de ácido clorhídrico 8 M a un matraz que contiene 100 mL de una disolución de hidróxido de sodio 1.5 M, formándose cloruro de sodio y agua.
a) Escribe y ajusta la reacción.
b) Indicar cuál es el reactivo limitante y cuál está exceso.
c) Calcula la cantidad del reactivo en exceso que queda sin reaccionar.
Masas atómicas: H = 1 ; Cl =35.5
-
Reactivo sobrante: Relación másica en la reacción de aluminio y bromo (6502)
El aluminio y el bromo reaccionan según la reacción:
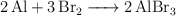
Se usan en la reacción 16 g de aluminio y 100 g de bromo, ¿cuál es la masa de reactivo sobrante?
Masas atómicas: Al = 27 y Br = 80.
-
Reacción de adición a doble enlace: masas de reactivos y producto
En una práctica de laboratorio un estudiante hace reaccionar 275 g de but-2-eno al 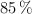 de pureza, con 0.095 L de ácido bromhídrico de pureza igual al
de pureza, con 0.095 L de ácido bromhídrico de pureza igual al 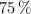 y una densidad de 1.49 g/mL. Determina:
y una densidad de 1.49 g/mL. Determina:
a) El mecanismo de la reacción.
b) ¿Cuánto reactivo en exceso queda sin reaccionar?
c) Cantidad consumida de los reactivos.
d) Cantidad de producto formado, si el rendimiento de la reacción es del 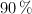 .
.
e) El nombre del producto utilizando la nomenclatura IUPAC.
 Reactivo limitante
Reactivo limitante