-
Problema equilibrio químico (615)
Sabiendo que la  a
a  para la formación del amoniaco vale
para la formación del amoniaco vale 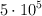 , calcula el valor de la nueva constante de equilibrio para una temperatura de
, calcula el valor de la nueva constante de equilibrio para una temperatura de 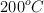 , sabiendo que la variación de entalpía del proceso es - 92 kJ.
, sabiendo que la variación de entalpía del proceso es - 92 kJ.
-
Comparar el cociente de reacción con la constante de equilibrio (598)
En un reactor de 3.5 L, y a 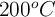 , se hacen reaccionar nitrógeno e hidrógeno para dar amoniaco. En un momento determinado, la composición del sistema es 0.249 moles de
, se hacen reaccionar nitrógeno e hidrógeno para dar amoniaco. En un momento determinado, la composición del sistema es 0.249 moles de 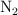 ,
, 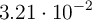 moles de
moles de 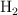 y
y 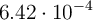 moles de
moles de 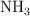 . Si la
. Si la  para la reacción, a esa temperatura, es 0.65, ¿habrá alcanzado el sistema el equilibrio? En caso de no estarlo, ¿hacia dónde evolucionará?
para la reacción, a esa temperatura, es 0.65, ¿habrá alcanzado el sistema el equilibrio? En caso de no estarlo, ¿hacia dónde evolucionará?
-
Cuestión equilibrio químico 0005
Las concentraciones en el equilibrio de las especies de la reacción 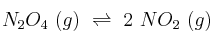 a 25 ºC, son 0,448 M para el reactivo y 0,0457 M para el producto. ¿Cuál es el rendimiento de la reacción?
a 25 ºC, son 0,448 M para el reactivo y 0,0457 M para el producto. ¿Cuál es el rendimiento de la reacción?
-
Problema equilibrio químico (392)
Cuando disolvemos zinc en ácido clorhídrico se obtiene un gas muy ligero como el hidrógeno. Si atacamos 3 g del metal con 85 mL del ácido (1.3 M) y la constante de equilibrio  (a 298 K) es 0.831:
(a 298 K) es 0.831:
a) ¿Cuál es la concentración de cada especie en el equilibrio?
b) ¿Cómo reaccionaría el equilibrio si dejamos escapar parte del hidrógeno producido?
-
Concentración en el equilibrio de un producto conocida la constante de equilibrio (243)
En un recipiente de 2 L, a 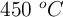 , se produce el equilibrio:
, se produce el equilibrio:
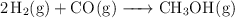
cuya  tiene un valor de 300. En el equilibrio hay 0.1 mol de
tiene un valor de 300. En el equilibrio hay 0.1 mol de 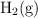 y 0.05 mol de
y 0.05 mol de 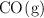 . Calcula la concentración de
. Calcula la concentración de 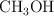 en el equilibrio, expresada en mol/L.
en el equilibrio, expresada en mol/L.
 Constante equilibrio
Constante equilibrio