-
Masa de magnesio que debe reaccionar con una cantidad de nitrógeno (4709)
¿Qué masa de magnesio se necesita para que reaccionen completamente 10 g de nitrógeno y formar nitruro de magnesio?
-
Masa de hidrógeno que se produce a partir de un cinc impuro (5062)
Se hacen reaccionar 22.75 g de cinc, que contienen un 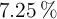 de impurezas, con ácido clorhídrico suficiente. Calcula la masa de dihidrógeno desprendida.
de impurezas, con ácido clorhídrico suficiente. Calcula la masa de dihidrógeno desprendida.
Masas atómicas: Zn = 63.38 u ; H = 1 u.
-
Dióxido de carbono emitido en un viaje y rendimiento del motor
La combustión del octano, uno de los componentes de la gasolina, genera el gas de efecto invernadero  , de acuerdo con la siguiente ecuación que se lleva a cabo con exceso de oxígeno:
, de acuerdo con la siguiente ecuación que se lleva a cabo con exceso de oxígeno:
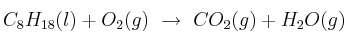
Considerando un vehículo cuyo consumo es de 12 km/L, calcula:
a) El volumen de gasolina, en galones, que se consume en un trayecto desde Duitama a Bogotá, que es de 200 km, sabiendo que un galón equivale a 3,785 litros.
b) El volumen de  que se genera, a
que se genera, a 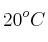 y a presión atmosférica (2 575 m de altitud) si se considera que la densidad de la gasolina es 680 g/L y que el porcentaje de pureza de octano en gasolina es
y a presión atmosférica (2 575 m de altitud) si se considera que la densidad de la gasolina es 680 g/L y que el porcentaje de pureza de octano en gasolina es 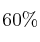 . Considera que la masa molar del
. Considera que la masa molar del  es 44 kg/kmol.
es 44 kg/kmol.
c) El rendimiento de la reacción si, en las mismas condiciones, es comprobó que el volumen de  generado fue de
generado fue de 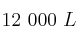 .
.
-
Combustión de carbón y ley de conservación de la masa (5026)
Cuando se queman 12 g de un carbón puro, se pesa el humo generado y se encuentra que la masa de humo es de 44 g. Responde a las preguntas:
a) ¿Qué masa de oxígeno habrá reaccionado con el carbón en la combustión?
b) ¿Cuál sería la masa de humo producido si se quemasen 30 g de carbón?
-
Composición porcentual de una mezcla de carbonatos
Los carbonatos de Mg y Ca se descomponen por calentamiento en el óxido correspondiente y en el dióxido de carbono. Una muestra de la mezcla de los dos carbonatos sufre, por calentamiento, una disminución del 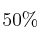 de su peso. Calcula la composicion centesimal de la mezcla.
de su peso. Calcula la composicion centesimal de la mezcla.
Masas atómicas: C = 12 ; O = 16 ; Mg = 24,3 ; Ca = 40.
 Reacciones químicas
Reacciones químicas